Análisis comparativo de la rugosidad de la superficie de seis implantes dentales de diferentes sistemas (C.E.) antes de la inserción ósea y después del efecto de las fuerzas de inserción sobre la topografía de las superficies.
Dr. Alfredo Valencia Laseca,
Cirujano Oral y Maxilofacial. Médico Estomatólogo. Doctor en Medicina y cirugía, FEBOMS
(European Board Oral and Maxillofacial Surgery)
Mr. Miroslaw Pienkowski
Ingeniero experto metalurgia
Especialista Maxilofacial.
Dr.Dr. Matthias Peuten
Cirujano Maxilofacial. Médico Estomátologo, Doctor en Medicina y cirugía,
Universidad de Erlangen.
Especialista en cirugía plástica.
Correspondencia:
Titanium Clinic.
Carretera Nacional de Cádiz, Km. 340 s/n. Urbanización Marbella Mar. Local 2.
Marbella. Málaga. España.
http://www.titaniumclinic.com/
RESUMEN
Hay consenso en considerar la estructura de la superficie de los implantes como característica de máxima importancia en el éxito clínico de la implantología oral.(1) Existe abundante documentación bibliográfica sobre la rugosidad de la superficie antes de la inserción. Sin embargo, si consideramos los efectos de las fuerzas de fricción en la inserción de las fijaciones y su repercusión en las rugosidades de las superficies enosales, en nuestra búsqueda bibliográfica no se encontraron evidencias de estudios que analicen el comportamiento de la zona enosal del implante sometida a la acción de las fuerzas de fricción (torque) tras la inserción en el lecho óseo. Nuestro objetivo es analizar la topografía rugosa obtenida mediante idéntico procedimiento en seis implantes de diferentes diseños, comparando los resultados de la posible afectación del relieve de la microrugosidad una vez que se han insertado en el hueso (Fig.1); además relacionamos los resultados obtenidos con las diferentes formas físicas del diseño de los implantes: cilíndricos y cónicos, (conicidad) pasos de rosca anchos y estrechos, (pitch) (Fig. 2)
 |
|
Fig.1: Comportamiento de la superficie de los implantes antes y después de la inserción |
 |
|
Fig.2: Diseño de los implantes estudiados. |
Y el comportamiento de la topografía de la micro y nanoestructura de las diferentes superficies estudiadas, relacionándolas entre ellas, y siguiendo los postulados de Boyan (2) en su relación con la idoneidad del crecimiento de los osteoblastos y los relieves resultantes ante el estudio minucioso de los mismos. Los resultados de nuestro trabajo demuestran con evidencia que el profesional, ante la elección de un sistema de implantes, debe de tener en cuenta el comportamiento de la rugosidad de las superficies de los implantes elegidos, frente a las fuerzas de torque, ya que éstas tendrán no sólo gran repercusión en la estabilidad del implante al insertarse en el hueso o «Bone Impact Contact» (BIC), sino en la predictibilidad del comportamiento de los osteoblastos, y consecuentemente en el éxito clínico del tratamiento implantológico, sobre todo a largo plazo y en situaciones de carga inmediata y/o carga precoz .(3)
Palabras Clave: Implantes dentales ,rugosidad de superficie del implante, microestructura enosal, torque de inserción, microtopografía
INTRODUCCIÓN
Los tratamientos de superficies en la parte enosal de los implantes de titanio de uso en implantología oral para conseguir la textura rugosa más adecuada, el estímulo de las células óseas y, en definitiva, una osteointegración más favorable, ha sido realizado por los fabricantes en los últimos años siguiendo estudios experimentales que han demostrado una interrelación entre las topografías rugosas de las superficies y las células óseas en su proceso de cicatrización y remodelación continua (4).
La gran competitividad del mercado sigue estimulando la investigación de las topografías de las superficies enosales con presentaciones en el mercado de novedades no suficientemente contrastadas con fines de impacto comercial sin el rigor de la evidencia clínica y de su repercusión en el éxito de los implantes a medio y largo plazo.
Los clínicos que tenemos gran experiencia debido, entre otras causas, a la cantidad de implantes insertados, sabemos que las promesas aseguradas por la industria en cuanto a sus novedades tecnológicas, casi siempre son más reclamos comerciales que realidades científicamente probadas, sobre todo con análisis y metaanálisis a largo plazo.
No olvidemos el excesivo número de fracasos de implantes dentales de una marca reconocida (5) que todos sufrimos en maxilar superior, y cómo los comerciales de la compañía negaban la evidencia haciendo creer al profesional que él era el único que tenia tales índices de fracasos, por lo que nos culpabilizaban de defectos de protocolo y de técnica.
MATERIAL Y MÉTODO
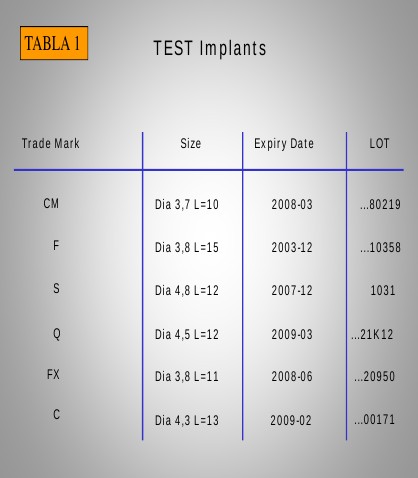
Utilizamos seis implantes dentales de titanio grado 4 fabricados en CE, cilíndricos, cónicos y cónicos escalonados, de diferentes longitudes, y todos con rugosidad enosal. (Tabla 1)
La superficie de los implantes se analiza mediante Microscopía Electrónica (S.E.M – GEMINI) (Universidad de Karlsrhue,Alemania).
Las superficies de las fijaciones analizadas se observaron y documentaron antes y después de la inserción ósea utilizando aumentos: 1:100 1:300 1:1000 1:3000 1:10000 1:30000
El hueso elegido para la inserción de los implantes fue costilla de vacuno.
El mismo especialista experto realizó la inserción de las fijaciones, utilizando en cada implante el protocolo estricto recomendado por el fabricante para su sistema. (Fig.3).
 |
|
Fig.3: Inserción de las fijaciones. |
Para la retirada de los implantes de la costilla y su observación microscópica posterior, se utilizan corticotomías con sierra para no crear fuerzas al desenroscar las fijaciones y evitar influencias de inserción no deseadas en nuestro estudio.
 |
|
Fig. 4:Corticotomía |
Retirados los implantes se limpian de materia orgánica utilizando ácido clorhídrico al 30% a temperatura ambiente durante diez minutos, así se elimina la parte orgánica sin influencias en la textura de la superficie de titanio de los implantes.
Además, sometimos a plasma oxigeno a aquellas superficies en las que las imágenes observadas a partir de 300 aumentos sugerían defectos de la rugosidad topográfica en algunos implantes, y por tanto ante dudas de contaminación biológica no suficientemente retirada con el ácido clorhídrico (Fig.5,6,7).
Defectos encontrados en la microtopografia:


Una vez seguros de la ausencia de restos orgánicos, se estudian las texturas de los implantes antes de la inserción, comparando unas con otras desde el punto de vista físico y hasta 30.000 aumentos. Por otro lado, hacemos lo mismo con las superficies después de la inserción, y posteriormente comparamos antes y después de la inserción a los diferentes aumentos cada una de ellas por separado.
DISCUSIÓN Y RESULTADOS
Para analizar la microtopografía de las rugosidades se utilizan como parámetros de referencia los descritos por Boyan y Schwarz (2) que hacen un estudio sobre la adaptación morfológica de los osteoblastos en función de la superficie rugosa y sus relieves, demostrando que:
-
Cuando los osteoblastos (Fig. 8) son cultivados sobre superficies lisas Ra < 2 µm adquieren una morfología fibroblástica aplanada, en superficies con Ra < 2 µm, Rm mayor a la longitud de la célula (Rm<10 µm), los osteoblastos se comportan como si fuese una superficie lisa adoptando la misma morfología que en el caso anterior.
-
Cuando Ra > 2 µm y Rm >10 µm, los osteoblastos morfológicamente se adaptan al perfil de la superficie. Si Ra > 2 µm y Rm<10 µm, los osteoblastos quedan retenidos a la superficie celular con mayor avidez a través de extensiones citoplasmáticas.
-
En superficies mixtas, el cultivo celular se comporta adquiriendo ambas morfologías. Teniendo en cuenta estos parámetros y considerando que durante el proceso de inserción existen unas fuerzas de fricción entre la superficie del implante y el hueso, y ante la evidencia que a mayor fricción mayor estabilidad primaria pero mas riesgo de afectación de la rugosidad. (Fig.8)
 |
|
Fig.8: Tipos de superficies. |
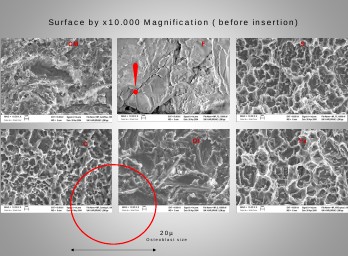
Se tomaron imágenes de las superficies de los implantes a 100-300-1000-3000-10000-30000 aumentos antes de insertarlos en el hueso, y así tener las referencias de microestructura de superficie y compararlas entre sí y con las resultantes después de ser insertados en el hueso.
MICROTOPOGRAFIAS DE LOS IMPLANTES (ZONA ENOSAL) ANTES DE LA INSERCIÓN:
Desde las macrotopografías a 1:100 todos los implantes presentan alguna contaminación por la técnica de chorreado para la rugosidad de superficie. (Fig. 9) El tamaño de las partículas contaminantes es relativamente pequeño, aproximadamente 2 µm. Consideramos que no influye el crecimiento osteoblástico, (7) por la bioinercia del óxido de aluminio, su pequeño tamaño y fuerte conexión con el titanio.
 |
|
Fig.9: Superficie de los implantes a estudiar. |
Encontramos en la estructura rugosa del implante F a 1: 10000 partículas contaminantes de gran tamaño, concretamente 150 µm, y sin conexión con la superficie, vemos además, que en este implante la rugosidad es mucho menor, este dato topográfico es de relevancia para el crecimiento osteoblástico al ser el tamaño celular de 20 micras. ( Fig.10,11 )
 |
|
Fig.10: Superficie de los implantes antes de la inserción. |
Mediante espectrometría de fotoelectrones (XPS) comprobamos que las partículas contaminantes de la superficie son de aluminio y que el resto de la topografía es de titanio. ( Fig 11)
 |
|
Fig.11: Defectos de superficie. |
En la observación de las rugosidades de los implantes S y Fx a 1: 30000, la estructura de superficie antes de la inserción es exactamente igual. (Fig 12). Si con un círculo rojo simulamos el tamaño aproximado del osteoblasto (20µm), podemos visualizar cómo la célula ósea se adaptaría a las condiciones topográficas de la superficie del implante, siguiendo un fenotipo favorable, recordando el estudio de Boyan y Schwarz.(2). (Fig.13)
 |
|
Fig.12: Superficie de los implantes antes de la inserción. |
 |
|
Fig.13: Superficie de los implantes antes de los inserción. |
MICROTOPOGRAFIAS DE LOS IMPLANTES (ZONA ENOSAL) DESPUÉS DE LA INSERCIÓN:
En las imágenes (1:10000) de la microtopografía comparativa de los implantes S y Fx se evidencia la pérdida total de la rugosidad de la superficie del implante Fx después de ser insertado en el hueso. (Fig.14)
Para corroborar este resultado insertamos de nuevo cinco implantes más de este sistema, obteniendo la misma imagen en todos los casos. Por lo que podemos afirmar que la microtopografía del implante Fx no soporta las fuerzas del torque de inserción ósea borrándose el relieve que presentaba antes de ser insertado; sin embargo la rugosidad de la superficie del implante S no se ve afectada por las fuerzas de fricción del torque de inserción, permitiendo la correcta adaptación de las células óseas para un perfecto BIC (Bone Implant Contact).
 |
|
Fig.14:Implantes Fx y S, antes y después de la inserción. |
Los implantes C, M, S, C y Q, no presentan cambios en la rugosidad entre ambos momentos, pre y post-inserción. (Fig. 15,16) No podemos deducir de las imágenes la existencia de fuerzas direccionales o de fricción (huella sobre la superficie debido a la dureza del implante).
Nos planteamos, tras el análisis de todas las superficies estudiadas mediante macro y nano imágenes, la reflexión del por qué en diferentes implantes, si tienen la misma topografía de superficie antes de la colocación en el hueso, presentan afectación diferente en sus relieves después de ser estudiadas al retirarlos de su lecho óseo, en definitiva al ser sometidas a fuerzas de torque de inserción ósea.
 |
| Fig.15: Implantes CM, Fx, S, antes y después de la inserción. |
 |
| Fig.16: Implantes C, Q, F, antes y después de la inserción. |
Para explicar este fenómeno hacemos referencia a las diferencias en el diseño del implante:
-
Cilíndrico o cónico.
-
Diferentes conicidades.
-
Excentricidad de la rosca de inserción.
-
Distancia entre rosca y rosca (pitch).
Si en nuestro análisis hay implantes de diseño cónico en los que su topografía no se destruía por el torque (Fig 17). Deducimos que: la combinación de implantes con diseño cónico y pequeños pasos de rosca (pitch) son los más susceptibles a una destrucción de la rugosidad.
 |
| Fig.17: Implante de diseño cónico no destruido por el torque. |
CONCLUSIONES
El distinto comportamiento de la rugosidad de la superficie de los implantes dentales frente a las fuerzas de torque de inserción, evidenciado en este trabajo obliga moralmente a los profesionales de la implantología de tener presente las siguientes conclusiones para obtener éxito clínico de los implantes utilizados:
Las microtopografias de los implantes analizados antes de la inserción demuestra que, no todas cumplen los mismos requisitos estructurales para una buena predictibilidad en la futura osteointegración o BIC (Bone Impact Contact).
Para una optima adaptabilidad de los osteoblastos a la superficie enosal de los implantes, en base a los conocimientos actuales, la topografía rugosa de las fijaciones debería tener una rugosidad definida por: Ra > 2 µm, Rm <12 µm. (Fig.18)
 |
| Fig.18: Topografía de la superficie antes de la inserción. |
Aquellas rugosidades de superficie que no cumplan estos requisitos precisan de más estudios científicos para poder concluir si son aptas para una buena osteointegración
En todos los implantes analizados hemos observado contaminación de polvo ambiental con un tamaño muy reducido (de pocas micras). Probablemente este hecho no tiene una influencia significativa en la osteointegración.
No obstante, aunque vemos que la contaminación de las rugosidades de la superficie son visibles en los seis sistemas, podrían no tener la misma repercusión clínica, ya que en algún caso el área contaminada es significativamente mayor que el tamaño de los osteoblastos.
Antes de la inserción, solamente un implante (F) mostraba una extremada baja rugosidad en comparación con los otros sistemas analizados.
Después de la inserción hemos observado destrucción de la microestructura de la superficie únicamente en un implante cónico (Fx).
Probablemente la causa es el pequeño paso de rosca (pitch) que presenta. Unido a la conicidad Por tanto, deducimos que macrodiseños del implante pueden tener una gran influencia en la estabilidad micro o nano de la microestructura de la superficie de los implantes en su relación con el hueso receptor.
Cuando la estructura rugosa de las superficies de los implantes se somete a las fuerzas friccionantes de inserción, la topografía de dicha estructura se modifica en función del diseño del implante, cónico o cilíndrico, y del tamaño del paso de rosca o pitch.
El clínico especialista debe tener presente a la hora de seleccionar el sistema de implantes que si opta por implantes cilíndricos, el paso de rosca podrá ser muy reducido. Sin embargo, si al buscar máxima estabilidad primaria se declina por implantes cónicos el paso de rosca debe ser mayor, ante el importante aumento del stress en la zona más frágil del implante. (Fig. 19,20)
 |
| Fig.19: Ricci. Superficie de la microestructura de los implantes. |
 |
| Fig.20: Imagen de superficie. |
BIBLIOGRAFÍA
1.- Ericsson I,Johansson CB, Bystedt H, Norton MR.A histomorphometric of bone-to-implant contact on machine-prepared and roughened dental implants. Clin.Oral Impl Res 1994; 5 : 202′-6
2.- Boyan BD, Hunmmerrt TW, Kieswetter K, Schraub DM,DeanDD,Schwartz Z. Effect of titanium surface characteristics on chondrocytes and osteoblasts in vitro . Cell Mater 1995, 5: 323-35
3.- Wennerberg Ann. On surface roughness and implant incorporation .(Thesis) Biomaterials Handicap Research. Institute for surgical Sciences. Goteborg Univ., 1996.
4.- Davues JE. Understanding Peri- Implant Endosseous Healing. J Den Educ 2003;67(8) 932-49.
5.- Carlsson L, Rostlund T, Albrektsson B,Albrektsson T. Removal -torque for polishedand rough titanium implants. Int J Oral Maxillofac Implants 1998;3:21-4
6.- Valencia A. Analisis Clinico sobre una muestra de implantes oseointegrados de diferentes sistemas: estudio retrospectivo(Tesis) Facultad de Odontologia.Universidad de Granada .2001,143-56
7.- Ricci et al. Laser made groups . Bone Engineering. Toronto 2000.

