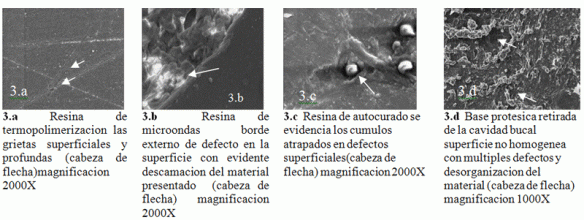
Las férulas dentales son dispositivos fabricados, por el protésico dental, de materiales plásticos o resinas acrílicas, que recubren total o parcialmente los arcos dentarios.
Archivo de la categoría: Artículos
Terceros molares impactados; Evolución del proceso quirurgico. Revisión de la literatura
AUTOR: Guillermo Enrique Blanco Ballesteros
RESUMEN
La cirugía de terceros molares impactados es un procedimiento muy común en la cirugía oral, con los años la técnica e instrumental han cambiado, todos estos avances han permitido brindar comodidad al profesional y al paciente, disminuyendo de esta forma el impacto traumático ocasionado por el tratamiento quirúrgico. Comparar estos avances del pasado y observando el presente de estos en beneficio de lograr un mejor resultado operatorio.
ABSTRACT
The impacted third molar surgery is a very common procedure in oral surgery, over the years and instrumental techniques have changed, these advances have allowed the professional and provide comfort to the patient, thus reducing the traumatic impact caused by the treatment surgical. Compare these advances of the past and present of watching these for the benefit of a better surgical outcome.
PALABRAS CLAVE
Terceros molares impactados, técnica quirúrgica, instrumental quirúrgico.
KEY WORDS
Impacted third molars, technique surgical., surgical instruments.
INTRODUCCIÓN
El tratamiento quirúrgico de los terceros molares es un tema fascinante para cualquier cirujano oral y es uno de los procedimientos más realizados en los tratamientos odontológicos. Es satisfactorio leer como ha evolucionado este procedimiento con el transcurrir de los años y con la tecnología, este procedimiento tiende hacer menos traumático .
RECORRIDO POR EL PASADO
El proceso evolutivo del tratamiento quirúrgico de los terceros molares es muy rico en cuanto a la literatura, estos textos son un legado del trabajo de muchos cirujanos que en su momento sirvieron de referencia para realizar este procedimiento y también para motivarlos a seguir esta especialidad.
Como con el transcurrir de los años han cambiado algunos instrumentales y surgieron otros, se depuraron algunas técnicas y con los avances tecnológicos en beneficio del paciente, intentando disminuir el incomodo proceso de convalecencia en los pacientes sometidos a este procedimiento.
1-IMPACTACIÓN Y DIFICULTAD
En 1926, Winter1 presentó un trabajo para la clasificación de los terceros molares retenidos en cuanto a su posición dentro del maxilar (mesioangular, horizontal, vertical, distoangular, vestibuloversión, linguoversión), en 1933, Pell y Gregory 2presentan una clasificación teniendo en cuenta su posición del maxilar, teniendo como referencia la posición del tercer molar con la rama ascendente mandibular y la profundidad relativa del tercer molar y la posición de el tercer molar en relación al eje axial del segundo molar inferior, estas 2 referencias son utilizadas hoy día como la norma de referencia en la evaluación de candidatos a cirugía de terceros molares impactados3-12.
Macgregor fue uno de los primeros en proponer un modelo para determinar el grado de dificultad quirúrgica13.
Aunque Tamashiro et al. clasifican la retención desde otra óptica y es el grado de dificultad quirúrgico, en una combinación de trabajos como los de Winter, Pell y Gregory y Ginestet, teniendo como base la localización anatómica como; el seno maxilar, conducto dentario inferior, agujero mentoniano y piso nasal, consideran que esto es lo que va a determinar el grado de dificultad al momento de realizar la extracción.
Tipo I: La corona se observa clínicacamente parcial y/o totalmente en la cavidad oral.
TipoII: La corona no se observa clínicamente, radiografícamente se localiza en limites que circundan el hueso alveolar.
TipoIII: Todas aquellas retenciones que se encuentran ubicadas fuera de la zona anatómica que les correspone14.
Abu-el naaj et al proponen una clasificación del tercer molar TMC, teniendo en cuenta una posición relativa del diente con respecto al canal alveolar.
TMC I: Tercer molar erupcionado y/o impactado que sus raíces se encuentran por encima del canal del nervio dentario inferior y se observa en una radiografía panoramica.
TMC II A: Las raíces del molar se encuentran en relación con el canal y se observa un oscurecimiento, se necesita de un CT para verificar su verdadera relación con el nervio.
TMC II B: El cuerpo del diente se encuentra más profundo y en relación con el canal del nervio y sus raíces se encuentran más cerca de la basal.
TMC III: El diente está ubicado completamente por debajo del nervio dentario inferior15.
Las anteriores clasificaciones no serian posibles sin las técnicas de imagen que ayudan a clasificarlas.
2-TÉCNICAS DE IMAGÉN
El dr. Otto WALKHOFF de Braunschweig, Alemania, realizó la primera radiografía dental alrededor de 1896, este nuevo descubrimiento permitió a los odontólogos realizar estudios con propósitos de diagnostico y seguimiento de los tratamientos realizados en Odontología.
Se considera padre de la radiología panorámica es el profesor Yrjö V. Paatero de Helsinki, Finlandia (1948). y el dr. Eiko Sairenji del Japón, fue el primero en realizar el término Ortopantomografo para describir la película panorámica16.Su importancia en el diagnóstico oral y maxilofacial, es porque se observa en un conjunto los dientes, maxilar, mandíbula y otras estructuras anatómicas, fundamentales cuando se planea un procedimiento quirúrgico. Es una herramienta importante en la consulta diaria.
Las técnicas imagenológicas en odontología son la radiografía periapical 17, la oclusal, panorámica18-36, Fig 1,2,3.
La radiografía oclusal nos sirve para determinar la posición vestibular y/o palatina, lo mismo que la radiografía periapical con la técnica de Clark37,38.

Hounsfield (1972) es considerado el padre de la tomografía computarizada, existe un antes y después en imágenes diagnósticas, ya que la radiología convencional tenia limitaciones, como la presentación de 2 dimensiones de los objetos cuando este presenta tres dimensiones espaciales 17, la tomografía ha sido la técnica de imagen que demuestra con exactitud la ubicación de un molar dentro del maxilar y su relación con otras estructuras anatómicas importantes18-26
La tomografía computada en general adquiere un volumen 3d de forma axial con el desarrollo de los equipos de tomografía cone beam se está realizando una adquisición volumétrica 3d de forma cónica, permitiendo entre otras ventajas disminuir la irradiación y mejorando la resolución espacial y temporal específicamente en estudios de radiología oral y maxilofacial. Fig 4 y 5.
los nuevos equipos de radiografía oral presentan la novedad que son digitales y presentan un margen de distorsión más bajo, menor radiación, almacenamiento, reutilización, la imagen se puede imprimir en papel radiográfico o películas radiográficas, desventajas alto costo, resolución inferior 39. cabe resaltar que las más usada es la ortopantomografía como examen diagnóstico inicial y en casos que se necesite un examen exacto, es la tomografía computarizada el examen diagnóstico indicado.

3- ASEPSIA
Para realizar la asepsia del paciente debemos tener en cuenta ciertos elementos como: Los guantes quirúrgicos fueron introducidos gracias al Dr William Halsted, hoy contamos con guantes de látex, látex con bajo contenido de proteínas, copolimeros sintéticos , como el neoprenE y/o estireno, para aquellos pacientes y el personal médico con alergia al látex40, además de contar con guantes estériles empacados de forma individual y en diversas tallas y guantes no estériles en caja.
Los compuestos químicos utilizados para la antisepsia, usados antiguamente son diversos, como el bicloruro de mercurio40,alcohol, tintura de yodo, ácido fénico y tintura de merthiolate41, ahora contamos con clorexidina al 0,12% solución acuosa para la mucosa, iodofóros (iodo combinado con polivinilpirrolidona) 10% en solución acuosa y triclosan, un bisfenol sintético usado como antiséptico oral 0,3-2%42, otros agentes usados para desinfección son: aldehídos, derivados clorados, derivados yodados, detergentes catiónicos, gases como la propiolactona, metales pesados derivados de la plata y derivados de mercurio, todos estos se emplean en menor frecuencia43.
Equipos de esterilización; se utilizaban para esterilizar el instrumental, medios como esterilización con agua hirviendo agregando carbonato de sodio al 2% 15 ml x lt de agua para alcanzar una temperatura de 121° C, esterilización por calor seco, con los inconvenientes de largos periodos y deterioro del instrumental, esterilización en frio con soluciones químicas que no se consideran seguras para esterilización, largos periodos para desinfección y algunos producen corrosión y oxidación del instrumental metálico.
El autoclave es el mejor medio de esterilización, utiliza vapor, presión, temperatura y tiempo44, hoy se cuenta con indicadores biológicos, para verificar que la esterilización se lleve a cabo, bacillus stearothermophilus 45, ver la radiación ultravioleta con longitudes de onda entre 240-280nm, para esterilizar, la sala quirúrgica.
Óxido de etileno es un reconocido medio de esterilización con ciertas desventajas como son; periodos largos, altos costos y posibles complicaciones de salud para quienes manejan est os equipos, hay que hacer un seguimiento ocupacional a los mismos, se emplea el Bacillus subtilis, para medir su eficacia.
Plasma de peróxido de hidrogeno un nuevo sistema de esterilización es apropiada para instrumentos sensibles al calor y la humedad, se utiliza el bacillus stearothermophilus.
Plasma gaseoso, tiene la ventaja que limpia y desinfecta el instrumental, siendo capaz de remover capas de oxido si lo presenta el instrumental, no es tóxico al ambiente,la desventaja es su alto costo44.
Radiación ionizante, como rayos x y radioisótopos para equipos susceptibles o empacados al vacio 46.
4-JERINGA CARRPUL
Las primeras jeringas utilizadas eran de vidrio tipo luer, luego a aparecieron las tipo carpule, metálicas presentaban un dispositivo de agujas delgadas y un tope de plomo u otro metal que cumplía las funciones de tope47,tipo luer muy diferente a las disponibles actualmente (esterilizadas y diferentes calibres y tamaños).Fig.6,7,8
Las jeringas tipo Carpul han evolucionado y existen diferentes modelos y tipos, ahora contamos con Sistemas electrónicos de anestesia (Midwest® Denstply y Wand®Milestone Scientific), que tienen defensores y opositores. Fig.9-10

5- BISTURÍ
Existían bisturí de un solo cuerpo que afilaba en cada cirugía48, ahora utilizamos Bisturí de Bard- Parker Fig. 11 con cuchillas intercambiables y diferentes formas 10, 11, 12, 12D, 15. 15C49 Fig.12, estas son utilizadas de acuerdo al criterio de cada cirujano en particular , también existen otros bisturí con otros modelos y diferentes al mango tradicional son una opción de acuerdo a la preferencia del cirujano. Fig. 13-14
Contamos con equipos como el electrocauterio50 con el que disminuye el sangrado y se obtiene una mejor visibilidad del área a intervenir y una herida libre de contaminación.fig.14-15.
Otros proponen el uso de laser para obtener una herida libre de contaminación disminuir dolor e inflamación51-53.


6-INCISIÓN
A lo largo de la historia encontramos diferentes tipos de incisión para el acceso quirúrgico como son : Mead 54(1930), Cogeswell55(1933), Avellanal56(1946), Ward57(1946), Maurel58 (1959), Kruger59(1959),Ries Centeno60(1960), Szymd61(1971), Berwick62(1971), Howe63(1971), Lotter64(1984), Berzaghi65(1989), Stevão66(1998), Saad Neto67( 2000), Nawesbwar68(2002), Suarez69(2003). Todas estas han sido propuestas para evitar daños a nivel periodontal distal al segundo molar, obtener mejor acceso quirúrgico, disminuir dolor y inflamación, una de las complicaciones más comunes en este tipo de procedimiento quirúrgico. Pero Ninguna se ha establecido como la técnica ideal para evitar los efectos secundarios del tratamiento.

6-SUTURA
La sutura era seda negra que se enhebraba en las agujas, cagut, hilos de lino70, hoy contamos con diferentes formas y tamaños de la aguja desde 1/4, 3/8, 1/2, 3/4, de corte cónico, cortante , corte reverso, de origen, animal (cagut, seda), vegetal (Lino,Algodón),
Sintéticos(poliamida, poliéster, polietileno, polipropileno, ácido poliglicólico, polidioxanona), de diámetro de 2 a 11 -0,, largo de 13 cm a 2,5 mt, construcción (monofilamentar, multifilamentar(torcido, trenzado, con revestimiento «silicona o teflón»)71.
7- OSTEOTOMIA Y ODONTOSECCIÓN
Kruger, hace referencia en que no existía una técnica exacta para la exodoncia de terceros molares, existían dos corrientes una que estaba de acuerdo con remover suficiente hueso para retirar el diente de manera intacta y otra que sugería que el diente se debía seccionar para evitar hacer una osteotomía menos agresiva. El método para realizar la osteotomía y odontosección muchas veces se realizaba con cincel y martillo61,72.
Encontramos elementos como; el torno dental que consistía en un una pieza de que funcionaba con un sistema de poleas y pedal se utilizaba para la osteotomías, ayudados con fresas de carburo de tallo largo y corto, como también discos de carburo montados en mandriles, o el martillo automático, que consistía en el torno dental con una osteotomos especiales, que funcionaban como un taladro percutor, y permitía hacer las osteotomias73.Fig.39
La fabricación de piezas de mano accionadas por aire, Invención de John Borden74 en 1959 que conllevarían a su uso en los procesos de osteotomía dental y maxilar de una manera muy tímida, posteriormente el micromotor de aire a medidados de 1960, desplaza al antiguo torno dental.
La pieza de mano angulada a 45º y la fresa quirúrgica han modificado este procedimiento fundamental para le realización de este proceso. Hoy día contamos con Sistemas de piezas de mano eléctricas y con sistema de iluminación incorporado con diferentes programas y torque de acuerdo a la necesidad, Existen micromotores eléctricos con una serie de programas quirúrgicos para calibrar el torque durante la osteotomia y odontosección y sistema de irrigación incorporado, sistemas iluminación en los contra-angulo, piezas rectas y anguladas para los micromotores. El sistema de cirugía piezo eléctrica que es un mecanismo de ultrasonido Fig.40, Barone et al concluyen, que el tiempo quirúrgico con este sistema es más prolongado que el realizado convencionalmente con fresas y equipos neumáticos y eléctricos lo que se consideraria una desventaja, pero miniminiza la osteonecrosis y evita el daño al tejido blando circundante, disminuye el trismos, inflamación, el uso de analgésicos 75. Este Podría ser inspirado en aquel de taladro percutor que se utilizo en algúna época y que debió ser traumático y molesto para el paciente.Fig.39
Otra opción es el Laser para osteotomías con resultados in vitro muy satisfactorios, como una cicatrización más rápida comparados con el uso de fresas y piezas neumáticas, otra ventaja seria la detección automática de diferencias en cualidades de tejidos por medio de un sensor integrado para evitar daño a estructuras sensibles como vasos y nervios, ausencia de ruido atemorizante, menor índice de inflamación, trismus, y edema ,el tiempo de apertura fue más rápido, algunos equipos tienen la opción spray aire-agua, este mecanismo de corte por una interacción de energía láser con el spray de agua, que se conoce como efecto hidroquinético, lo que miniminiza o anula el daño térmico. Como desventaja de los laser tenemos un mayor tiempo operatorio y una técnica más dispendiosa, algunos consideran este procedimiento difícil.
Existen varias técnicas quirúrgicas para la extracción, una via sublingual utilizada por ampliamente por los ingleses, bajo anestesia general con cincel y martillo, descrita inicialmente por Ward6,15,82-91, la via bucal usando osteotomías con fresa para lograr acceso, osteotomías sagitales para molares muy profundos17,92-95, extraoral para molares cerca de la basal, corticotomias bucales y/o vestibular para molares profundos96.
DISCUSIÓN
1-Existen una cantidad de instrumental para realizar el procedimiento quirúrgico de terceros molares, el éxito del procedimiento no está determinado por los implementos utilizados en la cirugía, existen otros factores como la habilidad, destreza, conocimientos de la técnica, experiencia del cirujano y un entrenamiento adecuado. Los avances tecnológicos pueden disminuir las posibles complicaciones postoperatorias, depende de los diferentes profesionales conocerlos y aplicarlos correctamente.

CONCLUSIONES
1-Ha Sido halagador ver como han sido modificados muchos de los procedimientos actuales, hoy contamos con un mayor conocimiento sobre la correcta esterilización y las técnicas más conservadoras para tratamientos quirúrgicos.
2-La tecnología ha permitido la incorporación de nuevos equipos que mejoran el procedimiento quirúrgico y también el perfeccionamiento de algunos equipos que en el pasado sirvieron para realizar estos procedimientos.
3- los avances tecnológicos y conocimientos en todos los acampos de la salud, han permitido mejorar el procedimiento quirúrgico de la exodoncia de terceros molares en aras de disminuir el trauma, ansiedad y disminuir algunos efectos adversos que antiguamente se producían por no tener los conocimientos y equipamientos adecuados.
AGRADECIMIENTOS
Quiero agradecer por los dibujos de las diferentes incisiones, el » Martillo Quirúrgico» y el micromotor de polea a Erika Galvis Pallares.
BIBLIOGRAFIA
1- Winter, G. B. Impacted mandibular third molars. St. Louis: Ed. Amer. Med. Book Co. 1926
2-Pell, G. J,Gregory, G. T. Impacted mandibular third molars: classifications and modified technique for removal. Den. Digest. 1933:39;330
3-Raspall G. cirugía de las retenciones dentarias. En Cirugía oral. Raspall G. Edit. Médica Panamericana. 1994. Madrid. Capítulo 5 .Pág.155-158.
4-Chaparro A, Pérez S, ValmasedaE, Berini L, Gay C. Morbidity of third molar extraction in patients between 12 and 18 years of age. Med Oral Patol Oral Cir Bucal 2005;10:422-431.
5-Akadiri O, Obiechina A. Assessment of Difficulty in Third Molar Surgery A Systematic Review. J Oral Maxillofac Surg. 2009; 67:771-774
6-Farish S, Bouloux G. General Technique of Third Molar Renoval. Oral Maxillofacial Surg Clin N Am 2000; 19: 23-43.
7-Laissle G, Aparicio P, Uribe F1, Alcocer D. Comparación del postoperatorio de dos colgajos en cirugía de terceros molares inferiores. Rev Esp Cir Oral Maxilofac 2009;31(3):185-192.
8-Llerena G, Arrascue M. Tiempo de cirugía efectiva en la extracción de los terceros molares realizadas por un cirujano oral y maxilofacial con experiencia. Rev Estomatol Herediana 2006; 16(1): 40 – 45.
9- Susarla SM, Dodson TB. How Well Do Clinicians Estimate Third Molar Extraction Difficulty?. J Oral Maxillofac Surg. 2005;63:191-199.
10- Susarla SM, Dodson TB. Risk factors for third molar extraction difficulty. J Oral Maxillofac Surg. 2004;62:1363-1671. 11-Ohshima A, Arij Y, Goto M, Izumi M, Naitoh M, Kurita K, Shimozato K, Arrigí E. Anatomical considerations for the spread of odontogenic infection originating from the pericoronitis of impacted mandibular third molar: Computed Tomographic analices. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004; 98(5):589-597.
12-Yuasa H, Kawai T, Sugiura M: Classification of surgical difficulty in extracting impacted third molars. Br J Oral Maxillofac Surg. 2002; 40:26-31.
13- Macgregor AJ: The radiological assessment of ectopic lower third molars. DDSc thesis, Leeds, UK, University of Leeds, 1976
14-Tamashiro T, Arias P. Alternativa en el manejo del paciente quirúrgico en 1,570 casos de terceros molares retenidos (Tratamiento efectivo utilizado para este estudio a lo largo de 10 años). Revista Odontológica Mexicana.2010:14(1);38-43
15-Abu-El Naaj I, Braun R, Leiser Y, Peled M. Surgical Approach to Impacted Mandibular Third Molars-Operative Classification. J Oral Maxillofac Surg 2010: 68:628-633.
16- http://depositodental.tripod.com/historia-rx.html Descargado Agosto 20 de 2011
17-Sencimen M, Varol A, Aydin Gülses A, Altug A. Extraction of a deeply impacted lower third molar by sagittal split osteotomy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108:e36-e38.
18- Landi L, Manicone P, Piccinelli S ,Raia A, Raia R. A Novel Surgical Approach to Impacted Mandibular Third Molars to Reduce the Risk of Paresthesia: A Case Series. J Oral Maxillofac Surg. 2010; 68:969-974.
19- Campbell A, Costello B. Retrieval of a Displaced Third Molar Using Navigation and Active Image Guidance. J Oral Maxillofac Surg. 2010;68:480-485.
20- Susarla S, Blaese Br, Magalnick D. Third molar surgery and associated complications. Oral Maxillofacial Surg Clin N Am 2003;15:177-186.
21- Bouloux G, Steed M, , Perciaccante V. Complications of Third Molar Surgery. Oral Maxillofacial Surg Clin N Am 2007; 19: 117-128.
22-Pasqualini D, Cocero N, Castella A, Mela L, Bracco P. Primary and secondary closure of the surgical wound after removal of impacted mandibular third molars: a comparative study. Int. J. Oral Maxillofac. Surg. 2005; 34: 52-57.
23- Szücs A, Péter Bujtár P, Sándor G, J Barabás J. J Can Dent Assoc2010;76:a72.
24-Tagara H , Ng S. Diagnostic difficulties of complex root morphology: case study of a lower wisdom tooth. British Journal of Oral and Maxillofacial Surgery.2005; 43: 177-179.
25- Lübbers HT, Matthews F, Damerau G, Kruse AL, Obwegeser JA, Grätz KW, Eyrich GK. Anatomy of impacted lower third molars evaluated by computerized tomography: is there an indication for 3-dimensional imaging? Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2011; 111:547-550.
26- Susarla SM, BA, Dodson TB. Preoperative Computed Tomography Imaging in the Management of Impacted Mandibular Third Molars. J Oral Maxillofac Surg2007; 65:83-88.
27-Zadik Y, Levin L. Decision Making of Israeli, East European, and South American Dental School Graduates in Third Molar Surgery: Is There a Difference? J Oral Maxillofac Surg2007: 65:658-662.
28- Gomes AC, Vasconcelos BC, Silva ED, Caldas Ade F Jr, Pita Neto IC. Sensitivity and specificity of pantomography to predict inferior alveolar nerve damage during extraction of impacted lower third molars. J Oral Maxillofac Surg. 2008;66(2):256-259.
29- Almendros N, Alaejos E, Quinteros M,. Berini L,Gay C-Escoda: Factors influencing the prophylactic removal of asymptomatic impacted lower third molars. Int. J. Oral Maxillofac. Surg. 2008; 37: 29-35.
30- Kalantar M, Shafeie H. Technique to manage simultaneously impacted mandibular
second and third molars in adolescent patients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:464-466.
31- Friedrich R, Ulbrich C, Baronesse L. The influence of wisdom tooth impaction on root formation. Ann Anat.2003; 185:481-492.
32- Bodner L, Brennan P b, McLeo N. Characteristics of iatrogenic mandibular fractures associated with tooth removal: review and analysis of 189 cases. British Journal of Oral and Maxillofacial Surgery. . 2011 49(7):567-572.
33- Singh H, Lee K, Ayoub A. Management of asymptomatic impacted wisdom teeth: a multicentre comparison. British Journal of Oral and Maxillofacial Surgery 1996;( 34): 389 -393.
34- Wagner K, Otten J, Schoen R, Schmelzeisen R. Pathological mandibular fractures following third molar removal. Int. J. Oral Maxillofac. Surg. 2005; 34: 722-726.
35- Baykul T, Erdem E, Dolanmaz D, Alkan A. Impacted Tooth in Mandibular Fracture. J Oral Maxillofac Surg 2004:(62):289-291.
36- Bell G. Use of dental panoramic tomographs to predict the relation between mandibular third molar teeth and the inferior alveolar nerve Radiological and surgical findings, and clinical outcome. British Journal of Oral and Maxillofacial Surgery 2004;(42): 21-27.
37- De Freitas R. Marin JL Cirurgia dos dentes inclusos, Capítulo 10. Pág 154-157. En Cirurgia bucomaxilofacial. De Freitas R. São Paulo: Edit Santos. 2006.
38- Ries GA. Estudio radiográfico de los maxilares y de sus estructuras. Anestesia. Parte primera. En cirugía bucal. Ries GA. Pág.16-17. Buenos Aires: Ed. El Ateneo, 1979.
39-Barbieri G, Flores J, Escribano M, Discepoli N.Actualización en radiología dental. Radiología convencional Vs digital. Av. Odontoestomatol 2006; 22-2: 131-139.
40- De Freitas R. De Souza D. Assepsia, anti-sepsia, esterilização e biosegurança,Capítulo 3. Pág 16,20. En Cirurgia bucomaxilofacial. De Freitas R, São Paulo: Edit Santos. 2006
41- Ries GA. Técnica quirúrgica. Parte segunda. En cirugía bucal. Ries GA. Pág.69. Buenos Aires: Ed. El Ateneo, 1960.
42- De Freitas R, De Souza D. Assepsia, anti-sepsia, esterilização e biosegurança,Capítulo 3..Pág 22-24. En Cirurgia bucomaxilofacial, De Freitas R. São Paulo: Edit Santos. 2006
43-Raspall G. El acto quirúrgico. Capítulo 3. En Cirugía oral. Raspall G. Edit. Médica Panamericana. 1994. Madrid. Capítulo 5 .Pág.30,35.
44- De Freitas R, De Souza D. Assepsia, anti-sepsia, esterilização e biosegurança,Capítulo 3..Pág 26. En Cirurgia bucomaxilofacial, De Freitas R. São Paulo: Edit Santos. 2006
45-Raspall G. Anestesia local y regional. Capítulo . En Cirugía oral. Raspall G. Edit. Médica Panamericana. 1994. Madrid. Capítulo 5 .Pág.30,35.
46- Hall H.Kruger G. Principios de la técnica quirúrgiaca. En Cirugia bucomaxilofacial. Kruger G .Edit Panamericana . 6 Ed 1986 México. Pág 23.
47- Ries GA. Anestesia. Parte tercera. En cirugía bucal. Raspall G. Buenos Aires: Ed. El Ateneo, 1979. Pág.97-99.
48- Ries GA. Sala de operaciones y dispositivos quirúrgicos. Parte tercera. En cirugía bucal. Raspall G. Pág.49 Buenos Aires: Ed. El Ateneo, 1979.
49-Raspall G. Acto quirúrgico. Capítulo 3. En Cirugía oral. Raspall G. Edit. Médica Panamericana. 1994. Madrid. Capítulo 5 .Pág.68.
50- De Freitas de R. Carvalho de C. Principios de técnica cirúrgica: diérese,hemostasia, síntese. Capítulo 4..Pág 34. En Cirurgia bucomaxilofacial. De Freitas R. São Paulo: Edit Santos. 2006
51- Amarillas E, Toranzo J, Martínez R, Loyola M, Hidalgo J, Fierro V, Gordillo A, Pozos A. Use of Therapeutic Laser After Surgical Removal of Impacted Lower Third Molars. J Oral Maxillofac Surg. 2010;68:319-324.
52- España AJ, Arnabat J, Berini-Aytés L, Gay-Escoda C. Aplicaciones del láser en Odontología. RCOE, 2004:9(5);497-511.
53-Guinot R, EspañaAJ, Berini-Aytés L, Gay-Escoda C Utilización de
otros láseres en Odontología: Argón, Nd:YAP y Ho:YAG. RCOE 2004; 9(5):581-586.
54- Mead SV. Incidence of impacted teeth. Int. Orthodont. oral Surg. Radiol., 1930;(16):885-890.
55- Cogeswell, WW. Variations in normal anatomic struture. J. Oral Sint. Ass. 1933;(20);2:1423-1427.
56-Avellanal, C. D. Cirugía odontomaxilar. Buenos Aires: Ed. Ediar, 1946.
57- Ward TG. The split bone technique for removal of lower third molars. Brit. dent. J, 1956;201; 297-304.
58- Maurel, G. Clinica y Cirugía maxilo-facial. Buenos Aires: Ed. Alfa, 1959.
59- Kruger, G. O. Management of impactions. Dent. Clin. N. Amer.1959; 707-722.
60- Ries Centeno GA. El tercer molar inferior retenido. Ries Centeno GA. Buenos Aires: Ed. El Ateneo, 1960.
61- Szmyd L. Impacted teeth. Dent Clin North Am 1971;15:299-318.
62- Berwick WA. Alternative method of flap reflection. Br Dent J 1966;20;121(6):295-296.
63-Howe GL The management of impactedmandibular third molars. In: Minor oral surgery. 2. ed. cap III, p.41-71. Bristol, 1971.
64- Lotter R. Periodontal considerations in the extracion of retained wision teeth varyng technics. Chir. Dent. Fr., 1984; 252:(5);35-44.
65- Berzaghi, CM Curcio R. Incisão em M.Revista da Ass. Paulista de Odontologia, 1989;43(5):32-34
66-Stevão EL, Azoubel E. Técnica alternativa para remoção de terceiros molares submucosos e intra-ósseos da mandíbula, BCI .1998;5(2):15-19
67-Saad neto, S.J.; et al. Sinopse de Cirurgia e Traumatología BucomaxiloFacial. Faculdade de Odontologia de Araçatuba, 2000.
68-Nageshwar. Comma Incision for Impacted Mandibular Third Molars. J Oral Maxillofac Surg 2002;60:1506-1509.
69-Suarez M, Gutwald R, Reichman J, Otero X, Schmelzeisen R. Marginal flap versus paramarginal flap in impacted third molar surgery: A prospective study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003;95:403-408.
70-Ries Centeno GA. Sala de operaciones y dispositivos quirúrgicos. Parte tercera. En cirugía bucal. Ries GA. Pág.68 Buenos Aires: Ed. El Ateneo, 1979.
71- De Freitas R. Carvalho de C. Principios de técnica cirúrgica: diérese, hemostasia, síntese. Capítulo 4.Pág 26. En Cirurgia bucomaxilofacial. De Freitas R.São Paulo: Edit Santos. 2006.
72-Kruger G. Dientes retenidos. En cirugia bucal y maxilofacial. Kruger G. Edit. Médica Panamericana.1984. México. Capítulo 2 Pág.90.
73-Ries Centeno G. Técnica quirúrgica. Parte 2. En cirugía bucal. Ries Centeno GA Editorial el ateneo 1979. Argentina. Pág. 51-53.
74- Historia de la odontología. URL: htpp://www.historiadelaodontologia.com
75-Barone A, Marconcini S, Giacomelli L, Rispolli L, Calvo J, Covani U. A Randomized Clinical Evaluation of Ultrasound Bone Surgery Versus Traditional Rotary Instruments in Lower Third Molar Extraction. J Oral Maxillofac Surg 2010:68:330-336.
76-Sasaki KM, Aoki A, Ichinose S, Yoshino T, Yamada S, Ishikawa I. Scanning electron microscopy and Fourier transformed infrared spectroscopy analysis of bone removal using Er:YAG and CO2 lasers. J Periodontol. 2002 ;73(6):643-652.
77- Rupprecht S, Tangermann K, Kessler P, Neukam FW, Wiltfang J. Er:YAG laser osteotomy directed by sensor controlled systems. J Craniomaxillofac Surg. 2003 Dec;31(6):337-342.
78- Pourzarandian A, Watanabe H, Aoki A, Ichinose S, Sasaki KM, Nitta H, Ishikawa I. Histological and TEM examination of early stages of bone healing after Er:YAG laser irradiation. Photomed Laser Surg. 2004 Aug;22(4):342-350.
79-Lee CY. A new method to harvest ramus bone using the erbium, chromium:yttrium-scandium-gallium-garnet laser. J Oral Maxillofac Surg. 2005 Jun;63(6):879-882.
80-Abu-Serriah M, Critchlow H, Whitters CJ, Ayoub A. Removal of partially erupted third molars using an Erbium (Er):YAG laser: a randomised controlled clinical trial. Br J Oral Maxillofac Surg. 2004 Jun;42(3):203-208.
81-Pourzarandian A, Watanabe H, Ruwanpura SM, Aoki A, Noguchi K, Ishikawa I. Er:YAG laser irradiation increases prostaglandin E production via the induction of cyclooxygenase-2 mRNA in human gingival fibroblasts. J Periodontal Res. 2005 Apr;40(2):182-186.
82- Ward TG. The split bone technique for removal of lower third molars. Br Dent J 1956;101:297.
83- Praveen G, Rajesh P, Neelakandan RS, Nandagopal CM.Comparison of morbidity following the removal of mandibular third molar by lingual split, surgical bur and simplified split bone technique. Indian J Dent Res. 2007 Jan-Mar;18(1):15-18.
84- Hindy AM, Ismaiel ME, Fayed N. Modified lingual split technique versus conventional buccal technique in odontectomy of impacted mandibular third molars. Egypt Dent J. 1995;41(2):1137-1144.
85- Rud J.Reevaluation of the lingual split-bone technique for removal of impacted mandibular third molars.J Oral Maxillofac Surg. 1984 Feb;42(2):114-117.
86-Rood JP.Lingual split technique. Damage to inferior alveolar and lingual nerves during removal of impacted mandibular third molars. Br Dent J. 1983 Jun 25;154(12):402-403.
87-Rood JP. Degrees of injury to the inferior alveolar nerve sustained during the removal of impacted mandibular third molars by the lingual split technique. Br J Oral Surg. 1983;21(2):103-116.
88-Lewis JE. Modified lingual split technique for extraction of impacted mandibular third molars.J Oral Surg. 1980;38(8):578-583.
89- Rood JP, Yates C, Buchanan M. Postoperative swelling and trismus after mandibular third molar removal with the lingual split bone technique. Int J Oral Surg. 1979;8(1):31-35.
90- Pogrel M,Goldman K. Lingual Flap Retraction for Third Molar Removal. J Oral Maxillofac Surg2004;62:1125-1130.
91-Obiechina A Oji C, Fasola A. Impacted mandibular third molars : depth of impaction and surgical methods of extraction among Nigerians. Odonto-Stomatologie Tropicale 2001:94;32-36.
92-Jones TA, Garg T, Monaghan A.Removal of a deeply impacted mandibular third molar through a sagittal split ramus osteotomy approach.Br J Oral Maxillofac Surg. 2004;42(4):365-368.
93- Precious DS. Removal of third molars with sagittal split osteotomies: the case for.J Oral Maxillofac Surg. 2004 Sep;62(9):1144-1146.
94- Boffano P, Gallesio C, Bianchi F, Roccia F. Surgical extraction of deeply horizontally impacted mandibular second and third molars. J Craniofac Surg. 2010;21(2):403-436.
95- Mehra P, Castro V, Freitas RZ, Wolford LM. Complications of the mandibular sagittal split ramus osteotomy associated with the presence or absence of third molars. J Oral Maxillofac Surg. 2001 ;59(8):854-8; discussion 859.
96- Tay A. Buccal corticotomy for removal of deeply impacted mandibular molars. British Journal of Oral and Maxillofacial Surgery2007;45: 83-84.
Expulsion of a lower third molar through the skin: A case report
Authors.
Josep Maria Oliva Díez: MD; Stomatologist. ABS La Pau. Barcelona. Institut Català de la Salut.
Carlos López Sánchez: MD; Stomatologist. ABS Raval Nord. Barcelona. Institut Català de la Salut.
Cristina Gracia Ruiz: MD; Stomatologist. ABS Raval Sud. Barcelona. Institut Català de la Salut.
José María Segura Noguera: MD; Family physician. ABS Raval Nord. Barcelona. Institut Català de la Salut.
Noemí Escuder Ferrando: Dental hygienist. Centre de Referència d’Odontologia (CRO). Barcelona. Institut Català de la Salut.
Corresponding author: Dr. Jose M Oliva
Address: C) Casp 186, atic 3
Work phone: (34)932788660
Home phone: (34)932700638
Fax: (34)933052804
Email: joliva.bcn.ics@gencat.cat
Keywords: dentigerous cyst, ectopic eruption, expulsion, skin, third molar, transcutanous fistula.
Abstract.
The eruption and transcutaneous expulsion of teeth from the oral cavity is an extremely rare phenomenon, but one which should be known. We report the case of a 63 year old woman who presented with a lower third molar situated ectopically in the inferior mandibular angle with an associated follicular cyst. After several infectious episodes, the tooth was expelled from the oral cavity through a transcutaneous fistula at the lower edge of the mandible. This is a very uncommon complication that may occur in non-erupted teeth, and which probably has not been reported in the literature previously, as a PubMed search on the keywords «third molar, ectopic eruption, expulsion, tooth, skin, transcutaneous fistula» returned no cases similar to the one described here.
Introduction.
Ectopic teeth are a frequent finding in general dentistry and primary care. The tooth most frequently located ectopically is the lower third molar (35%), followed by the upper canine (34%), the upper third molar (9%), the second lower premolar (5%), the lower canine (4%) and the upper central incisor (4%) with other teeth being less frequently seen.
The lower third molar can be found ectopically in different locations on the jaw. They have been described in the mandibular angle1, ramus2,3, condyle4,5 and coronoid process6. Ectopic teeth can remain in place for the life of the patient, but eruptions in atypical places are also frequent, the most common being inside the oral cavity itself, near the dental arches. When the position of the tooth is inverted, they can occasionally erupt outside of the oral cavity in locations such as the maxillary sinus7-9, nasal cavity10-12, chin13-15, lower mandibular ramus16-18, lip19-20, etc.
The causes of these ectopic teeth are varied: abnormal position of the dental follicle originating in the embryonic period, crowding, supernumerary teeth, trauma, infections, cysts, tumors, endocrine disorders and hereditary factors21.
We present what is probably the first published report of the expulsion of a wisdom tooth through the skin (PubMed), after obtaining consent from the patient for the publication.
Case Report.
A 63-year-old woman, with no relevant medical history, who presented to her primary care clinic in May of 2010 with a fistulated abscess in the right mandibular angle, which had produced a foreign body through the fistula six days before. The patient was referred to the clinic dentist, who noted the presence of a large abscess on the floor of the mouth and right mandibular angle, with a cutaneous fistula and severe pain, and confirmed that the foreign body expelled through the fistula and brought by the patient was a tooth, specifically a lower third molar (Figures 1 and 2).
In the anamnesis, the patient reported periodic abscesses in this area over the last four years, with fistulas and purulent suppuration, treated in each case with antibiotics and anti-inflammatories. An orthopantomography from 10 years prior showed the presence of the lower right wisdom tooth in full inclusion, three centimeters mesial to the mandibular angle and under the roots of the second molar, in an upright position, at a 35-degree disto-angulation and with its roots perforating or passing through the lower mandibular cortex. A follicular cyst with a diameter greater than two centimeters enveloped the entire crown of the wisdom tooth and extended almost completely from the lower to upper cortex (Figure 3).
The maxillofacial surgeons who had treated the patient in the past had advised her against surgery due to the difficulty of the intervention and the possibility of injuring the inferior alveolar nerve.
A new orthopantomography was taken (Figure 4), showing the absence of the lower right wisdom tooth, as well as a 3 cm (height) by 2 cm (width) osteolytic lesion, which spanned the entire thickness of the jaw from the superior to the inferior cortex, with hyper-condensed edges. No involvement of the second molar was seen. Suspecting acute osteomyelitis, a mandibular CT and bone scintigraphy were done (Figures 5 and 6) which corroborated the existence of a large osteolytic cavity in the right mandibular angle, with signs of acute inflammation, but with very well defined osteocondensed edges, a sign of the evolution of a dentigerous cyst.
The clinical evolution of the case was excellent. The patient reported significant improvement in symptoms immediately after the expulsion of the molar, with complete disappearance of inflammation and pain after six weeks of treatment with antibiotics and anti-inflammatories (875 mg/125 mg amoxicillin/clavulanic acid and 600 mg ibuprofen). She was discharged.
Eight months later, the case was followed up. The patient was clinically asymptomatic, except for mild paresthesia in the fourth quadrant. The scar left by the fistula was evident, with the skin hyperpigmented and slightly withdrawn along 1.5 cm (Figure 7). A new follow-up orthopantomography showed the cystic lesion had not resolved completely, but there were clear signs of healing and new bone trabeculation (Figure 8).
Discussion.
The eruption of a tooth outside the oral cavity is a very rare event, and very few cases have been described in the literature13-20. In these cases, the common factor tends to be the slow eruption of a tooth through the skin, without accompanying inflammatory or infectious symptoms, although the majority of authors report episodes of mandibular trauma (Shah, Ebling,)13,15 or osteomyelitis (Gadalla, Dash)14,16 months or even years earlier. The cases described by Gadalla, Ebling, Dash and Shah13-16, were thoroughly alveolated teeth with typical dental-alveolar gomphosis, normal morphology and characteristics, with surrounding skin that were somewhat withdrawn and hyperpigmented but healthy and which formed a good union with the tooth. Ebling15, who did an anatomical and pathological study of this union, found two to three lines of cells that form a junctional epithelium, surrounded by tissue rich in collagen fibers and lymphocytes. Dash16 produced positive results from vitality tests on the pulp of two mandibular molars that had erupted through the skin, which indicates that these teeth were alive as well as being fully erupted. In the x-rays, all of these teeth were inverted, as could be expected.
The present case differed substantially from these others in the sense that the molar did not erupt through the skin in a typical physiological process (although outside the oral cavity), but was abruptly expelled through a chronic fistula in the context of an important acute infection of the dentigerous cyst, which had encapsulated it for over a decade. The case is, then, a pseudo-eruption, a process more similar to the expulsion of a foreign body, much like the slow expulsion of retained root remnants of the alveolar ridge commonly seen in clinical practice. In the first orthopantomography (Figure 3), the wisdom tooth can be seen in an upright, not inverted, position. Abu-El Naaj et al.1 describe a case very similar to ours in which a wisdom tooth associated with a dentigerous cyst and repeated infectious episodes and a transcutaneous fistula had perforated the lower mandibular cortex and probably would have been expelled in the same way if it had not been extracted surgically first. We should emphasize that there are numerous cases of incisor fragments housed in the labial tissues after traumas that are later expelled as foreign bodies19,20,22-26, but we have not found any published cases of a molar such as ours (PubMed).
The causes of these disorders are not clear, and we can only form a hypothesis. Published cases of transcutaneous dental eruption all present prior trauma or mandibular infections, which hypothetically could have caused the inversion of the dental bud at an early stage, when the roots had not yet formed, and result in its later inverted eruption. Our case appears to be the result of the infection of a large and growing dentigerous cyst, which eventually perforated the inferior mandibular cortex and expelled the affected tooth through the resulting fistula as a foreign body.
We therefore concluded, that the emergence or outcome of a tooth through the skin may be due to two different pathologic processes: 1) An authentic process of dental eruption, because of an inverted position of the dental bud, or 2) A process of foreign body expulsion after acute or chronic infection of the tooth and soft tissues with cutaneous fistula, with the possible presence of an associated dentigerous cyst.
Conclusion.
The eruption or expulsion of teeth outside of the oral cavity, in the skin, maxillary sinus or nasal cavity are very unusual phenomena, but sufficiently frequent that a medical or dental practitioner may encounter them in clinical practice, and should be aware of them. A simple orthopantomography can provide a diagnosis in the majority of cases and should be done when alterations in the normal dental eruptive pattern are observed, as well as when there are antecedents of trauma or important infection of the jaws.
References.
Abu-El Naaj I, Braun R, Leiser Y, Peled M. Surgical approach to impacted mandibular third molars–operative classification. J Oral Maxillofac Surg. 2010 Mar;68(3):628-33. Epub 2009 Dec 23.
Wang CC, Kok SH, Hou LT, Yang PJ, Lee JJ, Cheng SJ, Kuo RC, Chang HH. Ectopic mandibular third molar in the ramus region: report of a case and literature review. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 Feb;105(2):155-61. Epub 2007 Aug 30.
Shane McCrea MSc, BDS, LDSRCS, MFGDP. Adjacent dentigerous cysts with the ectopic displacement of a third mandibular molar and supernumerary (forth) molar: a rare occurrence. Oral and maxillofacial implant.
Pace C, Holt D, Payne M. An unusual presentation of an ectopic third molar in the condylar region. Aust Dent J. 2010 Sep;55(3):325-7.
Yusuf H, Quayle AA. Intracondylar tooth. Int J Oral Maxillofac Surg 1989;18:323.
Toranzo FM, Terrones MMA. Infected cyst in the coronoid process. Oral Surg Oral Med Oral Pathol 1992; 73:768.
Büyükkurt MC, Tozoglu S, Aras MH, Yolcu U. Ectopic eruption of a maxillary third molar tooth in the maxillary sinus: a case report. J Contemp Dent Pract. 2005 Aug 15;6(3):104-10.
Felice R, Lombardi T. Ectopic third molar in the maxillary sinus-Case report. Austra Den J 1995;40:236-7.
Goh YH. Ectopic eruption of maxillary molar tooth-An unusual cause of recurrent sinusitis. Singapore Med J 2001;42:80-1.
Gupta YK, Shah N. Intranasal tooth as a complication of cleft lip and alveolus in a four year old child: case report and literature review. Int J Paediatr Dent. 2001 May;11(3):221-4.
Pracy JPM, Williams HOL, Montgomery PQ. Nasal teeth. J Laryrgol and Otol 1992;106:366-7.
Bappaditya Ray. Ectopic supernumerari tooth on the inferior nasal concha. Clinical Anatomy 2006; 19:68-74.
Shah N. Extraoral tooth eruption and transposition of teeth following trauma. Endod Dent Traumatol. 1994 Aug;10(4):195-7.
Gadalla GH. Mandibular incisor and canine ectopia. A case of two teeth erupted in the chin. Br Dent J. 1987 Oct 10;163(7):236.
Ebling H, Lopes JV. Ectopic eruption of a canine tooth in the chin. Oral Surg Oral Med Oral Pathol. 1966 Feb;21(2):151-3.
Jayanta Kumar Dash. Extraoral inverted teeth eruption: A case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004; 98:37-39.
Abdin Bey M. Eruption of a third molar through the skin. Quintessence Int (Berl). 1970 Jun;1(6):17-18.
Abdin Bey M. Eruption of a wisdom tooth through the external skin. Quintessenz. 1966 Dec;17(12):79-80.
Dhooria HS, Midy RN, Bowata RR. Foreign body rejection through lip: report of a case. Quintessence Int 1987; 18:163-4.
Rao D, Hegde S. Spontaneous eruption of an occult incisor fragment from the lip after eight months: report of a case. J Clin Pediatr Dent. 2006 Spring;30(3):195-7.
Gay Escoda C. Temas de Cirugía Bucal. Barcelona: Editorial Gráficas Signo S.A.; 1991. p. 587-609.
Snawder KC, Thomas J, Bastawi AE. Broken tooth fragments embedded in soft-tissues. J Pedod 46:145-147,1979.
Allen FJ. Dental fragments in the lips. Int J Oral Surg. 1981;10(Suppl 1):260-3.
Clark JC, Jones JE. Tooth fragments embedded in soft tissue: a diagnostic consideration. Quintessence Int. 1987 Sep;18(9):653-4.
Munerato MC, da Cunha FS, Tolotti A, Paiva RL. Tooth fragments lodged in the lower lip after traumatic dental injury: a case report. Dent Traumatol. 2008 Aug;24(4):487-9.
Pektas ZO, Kircelli BH, Uslu H. Displacement of tooth fragments to the lower lip: a report of a case presenting an immediate diagnostic approach. Dent Traumatol. 2007 Dec;23(6):376-9.
Mori SI; Kitamura K; Ohmari T. Inverted tooth eruption: report of a case. Oral Surg Oral Med Oral Path 1979; 12:389-90.
Symons AL. Ectopic eruption of a maxillary canine following trauma. Endod Dent Traumatol 1992;8:255-8.
Mitchell L. Displacement of a mandibular canine following fracture of the mandible. Br Dent Journal 1993; 174:417-8.
Donald MJ, Swinburn E. Tooth in the perioral tissues: a complication of craniofacial trauma. Am J Emerg Med. 2005 Jan;23(1):87-8.
Snawder KD, Bastawi AE, O’Toole TJ. Tooth fragments lodged in unexpected areas. JAMA. 1976 Sep 20;236(12):1378-9.
Acknowledgments.
We wish to express our gratitude to the Fundació IDIAP-Jordi Gol (Barcelona), for their help in the evaluation, translation and assessment of this manuscript.
Figures.
Figure 1: Acute fistularized submandibular phlegmon, six days after the expulsion of the molar.
Figure 2: Wisdom tooth carried by the patient and which was expulsed through the fistula.
Figure 3: Orthopantomography of the patient from 10 years prior to resolution, where the wisdom tooth is visible next to the lower edge of the mandible, encapsulated by the follicular cyst.
Figure 4: Orthopantomography of the patient after the expulsion of the wisdom tooth, in which the absence of the tooth and the large osteolytic cavity that spans the space between the superior and inferior mandibular cortex are evident.
Figure 5: Mandibular CT showing the large osteolytic cavity left by the wisdom tooth and the cyst.
Figure 6: Scintigraphy showing increased uptade in the right mandibular angle, sign of an acute inflammatory process.
Figure 7: Current state of the patient, showing hyper-pigmented and indented scar left by the fistula.
Figure 8: Follow-up orthopantomography showing the state of healing and bone regeneration of the lesion.
Provisional Implants in Dental Implant Therapy
Authors
José Manuel Mendes1, Marco Infante da Câmara2, Filomena Salazar2, Tomás Escuin Henar3
1 DDS, Msc, Phd, Coordinator of the Oral Rehabilitation Specialty .High Institute of Health Sciences North (ISCSN) – Portugal
2 DDS, Msc, Phd, Professor of the Oral Surgery Department. High Institute of Health Sciences North (ISCSN) – Portugal
3 DDS, Phd Coordinator of the Oral Rehabilitation Specialty Barcelona University Espanha
Abstract
Provisional implants are an indispensable tool to get adequate retention of fixed provisionals during osseointegration of primary implants. Provisionals implants have numerous applications and different surgical protocols related with the provisional implants brand. Provisional implants increase patient confort, function esthetics during osseointegration as well as prevent overload of the primary periimplant tissues.
Key-Words
Provisional implants, osseointegration, temporary prosthesis
Introduction
Osseointegration is one of the Keystones in Oral Rehabilitation, which allowed deep changes in Treatment Plan. Success in Osseointegration with endosseous implants was published in 1969 by Branemark and Cols.1
Implant Dentistry changed Oral Rehabilitation treatments with several advances towards not only function but also esthetics2. In the last four decades implant dentistry is a common treatment in both fully as in partially edentulous treatments3,4. Implants are a feasable treatment with high success rates 5,6,7 . Insuccess cases usually happen in the first few weeks after first stage surgery 8.
Immediate implants present several advantages over delayed implants with a considerable reduction of patient discomfort by decreasing surgical procedures 9.
Fully edentulous fixed rehabilitation with dental implants are nowadaysdone with four to six implants. A waiting period of 3 to 4 months of waiting period for osseointegration is a safe approach to achieve high success rates 10.
Immediate provisional implants allow immediate fxed function and esthetics with no load on the primary implants.
Indications
Immediate support for a fixed Prosthesis.
Immediate esthetics and stability of provisional prosthesis.
Soft tissues protection.
Protection of overload on the bone surrounding the primary implants.
Contraindications
Inadequate bone volume.
Incapacity of placement of enough provisional implants to sustain fixed Prosthesis.
Inadequate space between primary implants.
Lack of cortical bone for implant stabilization.
Provisional implants
Provisional implants are used with the purpose of delivering a fixed prosthesis in immediate loading with no risk to the primary implants. The provisional implants are removed after the osseointegration period. The Provisional implants allow immediate esthetic and function. Provisional implants can be of some assistance in the retention of Surgical guides (Fig 1)11.

Fig1 Surgical guide with barium sulfate stabilized by 6 provisional implants
Provisional implants are usually placed in the same surgical procedure as the primary titanium implants. Can also be used after dental extractions which allows delivering fixed provisional prosthesis (Fig.2)12.
Provisional implants can be used as anchorage in orthodontic treatments13,14.

Fig.2 6 Provisional implants placed after dental extractions
Oral Rehabilitation with provisional implants
Provisional implants are more commonly used in fully edentulous patients. Promotes protection the the primary implants.15
Several implant companies have different provisional implants.
Nobelbiocare, Gotemburg, Sweden developed a Provisional implant Kit with the following features:
- Single piece implant containing the abutment
- 2.8mm diameter
- 14mm of length
Provisional prostheses with this system are usually cimented.16
Provisional implants with attachments
Attachment system in provisional implants can be used in cases of extraction and immediate implant placement when provisional fixed prosthesis is required (Fig.3). During first stage surgery of the primary implants the provisional implants are placed. In this stage the attachments are placed inside the provisional prosthesis (Fig4) and secured in place with self curing resin. The fixed provisional prosthesisis cimented with provisional ciment (Fig5).

Provisional implants can function with just friction between male and female with no need for ciment.17
The procedure is similar in partially and fully edentulous patients. The purpose is to provide a fixed provisional in order to obtain,stability, esthetics and comfort. 18,19 Metal reinforced provisional (Fig 6) provides more stability.

Provisional implants with connecting bars (MTI – Monorail TM Transitional Implant System)
Provisional implants using connecting bars promotes stability and retention.
Dentatus provisional implant System has the following features:
- Gingival protective sleeves
- Connective bars
- Modular coppings
MTI should be placed 1.5 to 2mm away from the primary implants. The system allows divergency and angulation between the provisional implants.Mti Kit has a special tool to correct and achieve paralelim between provisional implants.
MTI system allows a load free osseointegration period of the primary implants as shown in the clinical case presented (fig 7). 12

Discussion
Oral Rehabilitation with provisinal implants require mulidisciplinary treatment between surgery and prosthodontics. The treament plan requires precision in the placement of the primary implants, provisional implants and the fixed provisional. The treatment with provisional implants allows immediate esthetics and function and guides us to the definitive prosthesis and protects the primary implants.15,20
Conclusion
Provisional implants don´t compromise the integration of the primary implants and provide a fixed oral provisional wich is an important tool in implant therapy specially in cases of guided bone regeneration.
Bibliografia
1. Branemark PI, Adell R, Brein U, Hansson BO, Lindstrom J, Ohlsson A. Intra-osseous anchorage of dental prostheses. I Experimental studies. Scand J Plast Reconstr Surg 1969; 3: 81-100.
2. Uludag B, Gozde G. Fabrication of a cement and screw-retained multiunit Implant restoration. JOI 2006; 32(5):248-50.
3. Mericske-Stern R. Overdentures with roots or implants for elderly patients: a comparison. J Prosthet Dent 1994; 72:543-50.
4. Heydecke G, Boudrias P, Awad MA, De Alburquerque RF, Lund JP, Feine JS. Within-subject comparison of maxillary fixed and removable implant protheses: Pacient satisfaction and choise of prothesis. Clin Oral Implants Res 2003; 14:125-30.
5. Wood MR, Vermilya SG. A review of selected dental literature on evidence-based treatment planning for dental implants: Report of the Committee on Research in Fixed Prosthodontics of the Academy of Fixed Prosthodontics. J Prosthet Dent 2004; 92:447-62.
6. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants. Success criteria and epidemiology. Eur Oral Sci 1998; 106: 527-51.
7. Quirynen M, De Soete M Steenberghe D. Infectious risks for oral implants: a review of the literature. Clin Oral Implants Res 2002; 13:1-19.
8. Weyant RJ, Burt BA. An assessment of survival rates and within-patient clustering of failures forendosseous oral implants. J Dent Res 1993; 72:2-8.
9. Chen ST, Darby IB, Adams GG, Reynolds EC. A prespective clinical study of bone augmentation techniques at immediate implants. Clin Oral Impl Res 2005; 16: 176-84.
10. Thomas D, Agar JR. Twenty years of progress in implant prosthodontic. J Prosthet Dent 2002;88:89-95.
11. Yeh S,Monaco EA, Buhite RJ. Using transitional implants as fixation screws to stabilize a surgical template for accurate implant placement: A clinical report. J Prosthet Dent 2005;93:509-13.
12. Simon H. Use of transitional implants to support a surgical guide: Enhancing the accuracy of implant placement. J Prosthet Dent 2002;87:229-32.
13. Lee LS, Park HS, Kyung HM,. Micro-implant anchorage for lingual tratment of a skeletal class II malocclusion. J Clin Orthod 2001; 35;643-7.
15. Babbush CA. Provisional implants: surgical and prosthetic aspects. Implant Dent 2001;10:113-20.
16. Babbush CA. Provisional implants: surgical and prosthetic aspects. Implant Dent 2001;10:113-20.
17. Ohkubo C, Sato JI, Hosoi T, Kurtz KS. O-ring attachments for transitional implant-retained overdentures. J Prosthet Dent 2004;91:195-7.
18. Balshi TJ. Converting patients with periodontally hopeless teeth to osseointegrated prostheses. Int J Periodontics Restorative Dent 1988;8:8-33.
19. Binon PP. The paramount role of transitional prostheses within implant prosthodontics-Part I. Dent Implantol Update 1995;6:49-53.
20. Chaimattayompol N. Transforming an existing fixed provisional prosthesis into an implantsupported fixed provisional prosthesis with the use of healing abutments. J Prosthet Dent 2002;88:96-9.
21. Siddiqui AA, Sosovicka M, Goetz M. Use of mini implants for replacement and immediate loading of 2 single-tooth restorations: a clinical case report. J Oral Implant 2006; 32;2:82-6.
Expulsión de un tercer molar inferior a través de la piel: a propósito de un caso
Autores.
Josep Maria Oliva Díez: Médico estomatólogo. ABS La Pau. Barcelona. Institut Catalá de la Salut.
Carlos López Sánchez: Médico estomatólogo. ABS Raval Nord. Barcelona. Institut Catalá de la Salut.
Cristina Gracia Ruiz: Médico estomatólogo. ABS Raval Sud. Barcelona. Institut Catalá de la Salut.
José María Segura Noguera: Médico de Familia. ABS Raval Nord. Barcelona. Institut Catalá de la Salut.
Noemí Escuder Ferrando: Higienista dental. Centre de Referència d’Odontologia (CRO). Barcelona. Institut Catalá de la Salut.
Autor para correspondencia: Dr. Jose M Oliva Díez
Dirección: C) Casp 186, atic 3
Teléfon del trabajo: (34)932788660
Teléfono domicilio: (34)932700638
Fax: (34)933052804
E-mail: joliva.bcn.ics@gencat.cat
Palabras clave: expulsión, tercer molar, erupción ectópica, piel, transcutánea, quiste dentígero.
Abstract.
La erupción y la expulsión de dientes fuera de la cavidad oral a través de la piel son un fenómeno extraordinariamente raro, pero que se debe de conocer. Presentamos el caso de una mujer de 63 años de edad, que presentaba un tercer molar inferior ectópicamente situado en el ángulo mandibular inferior con quiste folicular asociado, que tras numerosos episodios infecciosos, expulsó dicho molar a través de una fístula transcutánea en el borde mandibular inferior. Presentamos el caso para mostrar una complicación muy infrecuente a la que pueden dar lugar los dientes no erupcionados, y que probablemente sea la primera vez que se publica en la literatura, pues la búsqueda bibliográfica en PubMed mediante las palabras clave «third molar, ectopic eruption, expulsion, ejection, tooth, skin, transcutaneous» no ha identificado ningún caso como el que se describe en el presente manuscrito.
Introducción.
Las ectopias dentarias son un hallazgo muy frecuente dentro de la Odontología General y en la Atención Primaria de Salud. La pieza dental que más frecuentemente encontramos situada ectópicamente es el cordal inferior (35%), seguido del canino superior (34%), el cordal superior (9%), el 2º premolar inferior (5%), el canino inferior (4%) y el incisivo central superior (4%), siendo muy poco frecuente en el resto de las piezas dentarias.
El cordal inferior puede encontrarse situado ectópicamente en muchos lugares de la mandíbula. Así, se ha descrito su presencia en ángulo mandibular1, rama ascendente2,3, cóndilo4,5 y apófisis coronoides6. Los dientes ectópicos pueden permanecer incluidos toda la vida, pero también es frecuente que erupcionen en lugares aberrantes, lo más habitual dentro de la propia cavidad oral, en la vecindad de las arcadas dentarias, pero ocasionalmente, cuando la posición de un diente está invertida, puede erupcionar fuera de la cavidad oral, en lugares como el seno maxilar7-9, fosas nasales10-12, mentón13-15, rama mandibular inferior16-18, labio19-20, etc.
Las causas de dichas ectopias pueden ser muy variadas: posición anormal del folículo dentario desde el período embrionario, apiñamiento, dientes supernumerarios, traumatismos, infecciones, quistes, tumores, enf. endocrinas y factores hereditarios21.
Presentamos el que probablemente sea el primer caso descrito en la literatura de una expulsión de un tercer molar ectópico a través de la piel (PubMed), tras haber obtenido el consentimiento de la paciente para su publicación.
Caso clínico.
Mujer de 63 años de edad, sin antecedentes patológicos de interés, que acudió a su médico de cabecera de su Centro de Atención Primaria, en Mayo de 2010, por presentar flemón fistulizado en ángulo mandibular derecho, con expulsión séis días antes de un cuerpo extraño a través de la fístula. La paciente fue derivada al odontólogo del centro, quien constató la presencia de un importante flemón del suelo de la boca y ángulo mandibular derecho, con fístula cutánea y dolor importante, constatándose que el cuerpo extraño expulsado y que aportaba la paciente, se trataba de una pieza dentaria, concretamente de un molar inferior (fig. 1 y 2).
En la anamnesis, la paciente relató padecer desde hacía 4 años de flemones periódicos en esa zona, con fístula y salida de material purulento, siendo tratada siempre con antibióticos y antiinflamatorios. En una ortopantomografía realizada 10 años antes, se observaba la presencia del cordal inferior derecho, en inclusión completa, 3 cm. mesial al ángulo mandibular y bajo las raíces del 2º molar, en posición vertical, no invertida, con una distoangulación de 35º, y con sus raíces perforando o atravesando la cortical mandibular inferior. Sobre el cordal, se apreciaba un quiste folicular de más de 2 cm. de diámetro, que envolvía toda la corona de la pieza y que se extendía casi desde la cortical inferior a la superior (fig. 3).
Los cirujanos máxilo-faciales que en su momento la habían visitado, le desaconsejaron la intervención por la dificultad de la misma y la posibilidad de lesión del nervio dentario inferior.
Se le practicó una nueva ortopantomografía (fig. 4), en la que se observó la ausencia del cordal inferior derecho, más una gran imagen osteolítica de 3 cm. de alta por 2 cm. de amplia, que abarcaba todo el grosor del cuerpo mandibular, desde la cortical superior a la inferior, con rebordes hipercondensantes. No se vió afectación del 2º molar. Ante la sospecha de osteomielitis aguda, se realizó TAC mandibular y gammagrafía ósea (fig. 5 y 6) que corroboraron la existencia de una importante laguna osteolítica en ángulo mandibular derecho, con signos de inflamación aguda, pero de bordes osteocondensantes muy bien delimitados, signo de la evolución final del quiste dentígero.
La evolución clínica fue excelente. La paciente relató una mejoría muy importante de la sintomatología inmediatamente tras la expulsión del molar, con desaparición completa de la inflamación y el dolor tras mes y medio de tratamiento antibiótico-antiinflamatorio (amoxicilina clavulánico 875/125 e ibuprofeno 600). Se le dio el alta.
Ocho meses después, se le realizó un nuevo control. Clínicamente se encuentra asintomática, salvo unas ligeras parestesias en el 4º cuadrante. La cicatriz dejada por la fístula es evidente, con 1’5 cm. de leve retracción cutánea con hiperpigmentación (fig. 7). En la nueva ortopantomografía de control practicada se observa aún la persistencia de la lesión quística, pero con claros signos de curación y nueva trabeculación ósea (fig. 8).
Discusión.
La erupción de un diente fuera de la cavidad oral es una eventualidad muy rara, y son muy pocos los casos descritos en la literatura13-20. En estos casos, el factor común acostumbra a ser la lenta erupción de una pieza dentaria a través de la piel, sin signos inflamatorios o infecciosos acompañantes, aunque la mayoría de autores refieren el antecedente de un trauma mandibular (Shah, Ebling,)13,15 o procesos de osteomielitis (Gadalla, Dash)14,16 meses o incluso años antes. Los casos descritos por Gadalla, Ebling, Dash y Shah13-16, son dientes bien alveolados, con una gonfosis dentoalveolar típica, de morfología y características normales, cuya piel circundante está algo retraída e hiperpigmentada pero sana y forma una buena unión con el diente. Ebling15, que hace un estudio anatomopatológico de dicha unión, encuentra de 2 a 3 hileras de células a modo de epitelio de inserción, rodeado de un tejido rico en fibras colágenas y linfocitos. Dash16 realizó en dos molares erupcionados a través de la piel del cuerpo mandibular tests de vitalidad pulpar que fueron positivos, lo que indica que estas piezas además de estar bien erupcionadas, eran vitales. En las radiografías, todos esos dientes están, como cabe esperar, en posición invertida.
El presente caso difiere, por tanto, sustancialmente de los demás, en el sentido de que el cordal no ha erupcionado a través de la piel siguiendo un proceso de erupción cercano al fisiológico aunque fuera de la cavidad oral, sino que ha sido intempestivamente expulsado a través de una fístula crónica en el contexto de una infección aguda importante del quiste dentígero que desde hacía más de una década lo envolvía. El caso sería por tanto una pseudoerupción, un proceso clasificable más bien como de expulsión de cuerpo extraño, como en el caso de la lenta expulsión de restos radiculares retenidos de la cresta alveolar, tan comúnmente visto en la práctica clínica. En la ortopantomografía primera (fig. 3), el cordal se observa además en posición vertical, no invertida. Abu-El Naaj et al.1 describe un caso muy parecido al nuestro, en el que un cordal asociado a un quiste dentígero con episodios infecciosos repetidos y fístula transcutánea había ya perforado la cortical inferior mandibular y probablemente hubiera sido también expulsado de esa manera, si no se hubiera extraído antes quirúrgicamente. Hemos de resaltar que son numerosos los casos de fragmentos incisales alojados en el seno de los tejidos labiales tras traumatismos que posteriormente son expulsados como cuerpos extraños19,20,22-26, pero no hemos encontrado en la literatura ningún caso publicado como el nuestro, de un molar (PubMed).
Las causas de estos trastornos no están claras, y realmente sólo podemos formular hipótesis. Los casos de erupción dental transcutánea publicados, presentan todos antecedentes de traumatismos o infecciones mandibulares, que hipotéticamente habrían provocado la inversión del germen dentario en una etapa precoz, cuando las raíces aún no estaban formadas, y por tanto su posterior erupción invertida. Nuestro caso parece ser la consecuencia de la infección de un quiste dentígero de gran tamaño y en crecimiento, que acaba por perforar la cortical mandibular inferior y expulsar a través de la fístula el diente causal, como reacción de cuerpo extraño.
De todo lo dicho, podemos inferir que la emergencia o salida de un diente a través de la piel puede ser debida a dos procesos patológicos completamente diferentes: 1) Un proceso de auténtica erupción dentaria, por posición invertida del germen dentario, o 2) Un proceso de expulsión de cuerpo extraño tras infecciones agudas o crónicas fistulizadas a piel del diente y tejidos anexos, con posible presencia de un quiste folicular asociado.
Conclusión.
La erupción o expulsión de piezas dentarias fuera de la cavidad oral, a piel, seno maxilar o fosas nasales, son fenómenos muy inusuales, pero lo suficientemente frecuentes para que un profesional de la Medicina o de la Odontología pueda encontrárselos en la práctica diaria, por lo que debe de conocer su posibilidad. Una sencilla ortopantomografía nos dará el diagnóstico en la mayoría de los casos y debería de ser realizada siempre que se observen alteraciones en el patrón eruptivo normal de los dientes, así como cuando haya antecedentes de traumatismos o infecciones importantes de los maxilares.
Bibliografía.
- Abu-El Naaj I, Braun R, Leiser Y, Peled M. Surgical approach to impacted mandibular third molars–operative classification. J Oral Maxillofac Surg. 2010 Mar;68(3):628-33. Epub 2009 Dec 23.
- Wang CC, Kok SH, Hou LT, Yang PJ, Lee JJ, Cheng SJ, Kuo RC, Chang HH. Ectopic mandibular third molar in the ramus region: report of a case and literature review. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 Feb;105(2):155-61. Epub 2007 Aug 30.
- Shane McCrea MSc, BDS, LDSRCS, MFGDP. Adjacent dentigerous cysts with the ectopic displacement of a third mandibular molar and supernumerary (forth) molar: a rare occurrence. Oral and maxillofacial implant.
- Pace C, Holt D, Payne M. An unusual presentation of an ectopic third molar in the condylar region. Aust Dent J. 2010 Sep;55(3):325-7.
- Yusuf H, Quayle AA. Intracondylar tooth. Int J Oral Maxillofac Surg 1989;18:323.
- Toranzo FM, Terrones MMA. Infected cyst in the coronoid process. Oral Surg Oral Med Oral Pathol 1992; 73:768.
- Büyükkurt MC, Tozoglu S, Aras MH, Yolcu U. Ectopic eruption of a maxillary third molar tooth in the maxillary sinus: a case report. J Contemp Dent Pract. 2005 Aug 15;6(3):104-10.
- Felice R, Lombardi T. Ectopic third molar in the maxillary sinus-Case report. Austra Den J 1995;40:236-7.
- Goh YH. Ectopic eruption of maxillary molar tooth-An unusual cause of recurrent sinusitis. Singapore Med J 2001;42:80-1.
- Gupta YK, Shah N. Intranasal tooth as a complication of cleft lip and alveolus in a four year old child: case report and literature review. Int J Paediatr Dent. 2001 May;11(3):221-4.
- Pracy JPM, Williams HOL, Montgomery PQ. Nasal teeth. J Laryrgol and Otol 1992;106:366-7.
- Bappaditya Ray. Ectopic supernumerari tooth on the inferior nasal concha. Clinical Anatomy 2006; 19:68-74.
- Shah N. Extraoral tooth eruption and transposition of teeth following trauma. Endod Dent Traumatol. 1994 Aug;10(4):195-7.
- Gadalla GH. Mandibular incisor and canine ectopia. A case of two teeth erupted in the chin. Br Dent J. 1987 Oct 10;163(7):236.
- Ebling H, Lopes JV. Ectopic eruption of a canine tooth in the chin. Oral Surg Oral Med Oral Pathol. 1966 Feb;21(2):151-3.
- Jayanta Kumar Dash. Extraoral inverted teeth eruption: A case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004; 98:37-39.
- Abdin Bey M. Eruption of a third molar through the skin. Quintessence Int (Berl). 1970 Jun;1(6):17-18.
- Abdin Bey M. Eruption of a wisdom tooth through the external skin. Quintessenz. 1966 Dec;17(12):79-80.
- Dhooria HS, Midy RN, Bowata RR. Foreign body rejection through lip: report of a case. Quintessence Int 1987; 18:163-4.
- Rao D, Hegde S. Spontaneous eruption of an occult incisor fragment from the lip after eight months: report of a case. J Clin Pediatr Dent. 2006 Spring;30(3):195-7.
- Gay Escoda C. Temas de Cirugía Bucal. Barcelona: Editorial Gráficas Signo S.A.; 1991. p. 587-609.
- Snawder KC, Thomas J, Bastawi AE. Broken tooth fragments embedded in soft-tissues. J Pedod 46:145-147,1979.
- Allen FJ. Dental fragments in the lips. Int J Oral Surg. 1981;10(Suppl 1):260-3.
- Clark JC, Jones JE. Tooth fragments embedded in soft tissue: a diagnostic consideration. Quintessence Int. 1987 Sep;18(9):653-4.
- Munerato MC, da Cunha FS, Tolotti A, Paiva RL. Tooth fragments lodged in the lower lip after traumatic dental injury: a case report. Dent Traumatol. 2008 Aug;24(4):487-9.
- Pektas ZO, Kircelli BH, Uslu H. Displacement of tooth fragments to the lower lip: a report of a case presenting an immediate diagnostic approach. Dent Traumatol. 2007 Dec;23(6):376-9.
- Mori SI; Kitamura K; Ohmari T. Inverted tooth eruption: report of a case. Oral Surg Oral Med Oral Path 1979; 12:389-90.
- Symons AL. Ectopic eruption of a maxillary canine following trauma. Endod Dent Traumatol 1992;8:255-8.
- Mitchell L. Displacement of a mandibular canine following fracture of the mandible. Br Dent Journal 1993; 174:417-8.
- Donald MJ, Swinburn E. Tooth in the perioral tissues: a complication of craniofacial trauma. Am J Emerg Med. 2005 Jan;23(1):87-8.
- Snawder KD, Bastawi AE, O’Toole TJ. Tooth fragments lodged in unexpected areas. JAMA. 1976 Sep 20;236(12):1378-9.
Agradecimientos.
Queremos hacer constar nuestro agradecimiento a la Fundación IDIAP-Jordi Gol de Barcelona, por su ayuda en la valoración, traducción al inglés y asesoramiento del presente trabajo.
Figuras.
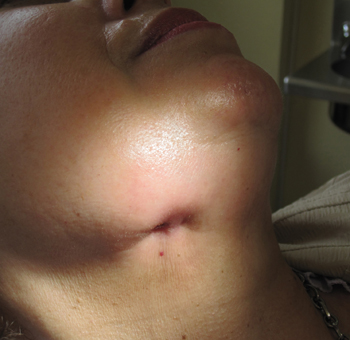
Fig. 1: Flemón submandibular fistulizado en fase aguda, séis días después de la expulsión del molar.

Fig. 2: Cordal que trajo la propia paciente en mano, y que había sido expulsado a través de la fístula.
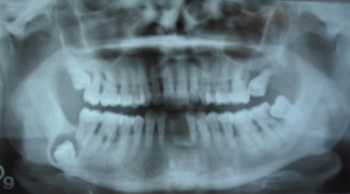
Fig. 3: Ortopantomografía antigua de la paciente, donde se observa el cordal junto al borde inferior del cuerpo mandibular, englobado por un quiste folicular.
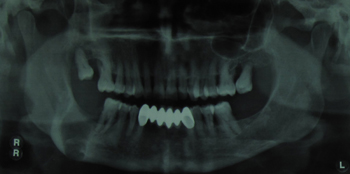
Fig. 4: Ortopantomografía tomada a la paciente tras la expulsión del cordal, en la que se aprecia la ausencia del mismo y una gran cavidad osteolítica que abarca todo el espacio entre las corticales superior e inferior mandibular.
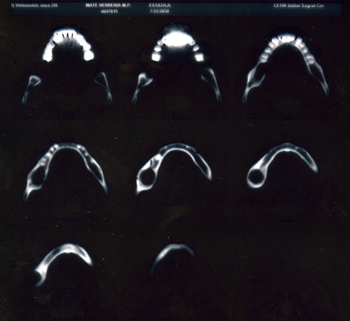
Fig. 5: TAC mandibular que muestra la gran cavidad osteolítica dejada por el cordal y el quiste.
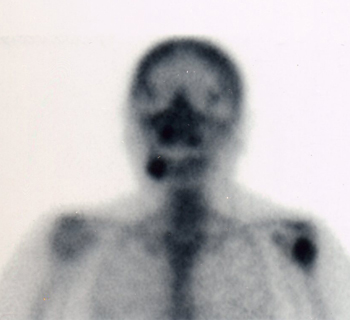
Fig. 6: Gammagrafía que muestra hipercaptación en el ángulo mandibular derecho, signo del proceso inflamatorio agudo.
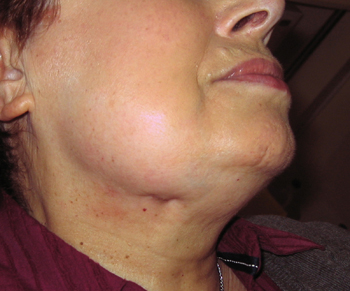
Fig. 7: Estado actual de la paciente, donde se observa la cicatriz algo retraída e hiperpigmentada dejada por la fístula.

Fig. 8: Ortopantomografía de control, donde se observa el estado de curación y regeneración ósea de la lesión.
Estratégias anti-microbianas na prevenção e tratamento da infecção oral
Estratégias anti-microbianas na prevenção e tratamento da infecção oral
Pina-Vaz I1, Barros J2, Noites R2, Villa-Vigil A3, Pintado M4, Carvalho MF1
1 MD, PhD. Department of Endodontics, Faculty of Dental Medicine, University of Porto, Portugal.
2 MD, PhD student, Department of Endodontics, Faculty of Dental Medicine, University of Porto, Portugal.
3 MD, PhD. Department of Dental Pathology and Terapeutics. Dental Materials. Dental Anatomy. Escuela de Estomatología de la Universidad de Oviedo, Spain.
4 PhD. Escola Superior de Biotecnologia, Universidade Católica Portuguesa, Porto, Portugal.
Corresponding author:
Irene Pina-Vaz
Faculdade de Medicina Dentária da Universidade do Porto
Rua Dr. Manuel Pereira da Silva
4200-392 Porto
Portugal
Telef.: 00 351 225 501 522
Fax: 00 351 225 507 375
e-mail: igapv@sapo.pt
Resumo
Introdução: A cavidade oral constitui um ecossistema propício ao desenvolvimento de biofilmes pois a variedade assinalável de superfícies da cavidade oral acomoda bactérias com tropismos diferentes. Do ponto de vista ecológico, representa um «sistema de crescimento aberto» devido à ingestão e remoção ininterrupta de microrganismos e dos seus nutrientes. Objectivo: O objectivo deste trabalho é rever a literatura existente e determinar o estado da arte sob o ponto de vista microbiológico em relação aos materiais disponíveis no tratamento das patologias periodontais e pulpar/periapicais, nomeadamente: colutórios, soluções irrigadoras, medicação intracanalar, cones de guta-percha e cimentos de obturação. Conclusão: É inquestionável as divergências dos resultados experimentais quanto à actividade antimicrobiana dos diferentes materiais, todos eles apresentam componentes antimicrobianos mas sem efeito bacteriano residual permanente. Actualmente, não há nenhum material disponível no mercado que satisfaça todos os critérios considerados ideais e com actividade antimicrobiana eficaz.
Abstract
Introduction: The oral cavity is an ecosystem that promotes the development of biofilm because the remarkable variety of surfaces in the oral cavity accommodates bacteria with different tropisms. From an ecological point of view, it represents an «open growing system» due to the endless intake and removal of microorganisms and its nutrients. Objective: the objective of this paper is to perform a literature review and to determine the state of art, on a microbiological level, of the materials for the treatment of periodontal and pulp/periapical pathologies, such as mouth rinsers, irrigating solutions, intracanal medication, gutta-percha points and endodontic sealers. Conclusion: the divergence in the experimental results regarding the antimicrobial activity of different materials is unquestionable, all of them showing antimicrobial components but with no permanent residual bacterial effect. Currently there are no available materials in the market that satisfies all the criteria that are considered ideal and with effective antimicrobial activity.
Introdução
A cavidade oral constitui um ecossistema onde, em condições normais, a sua população microbiana indígena não constitui uma agressão para as estruturas moles da mesma cavidade nem para a polpa dos dentes íntegros. Constitui um ambiente propício ao desenvolvimento de biofilmes pois a variedade assinalável de superfícies da cavidade oral acomoda bactérias com tropismos diferentes (1) e, do ponto de vista ecológico, representa um «sistema de crescimento aberto» devido à ingestão e remoção ininterrupta de microrganismos e dos seus nutrientes (2).
Apesar de todas as condições favoráveis, a cavidade oral apresenta vários obstáculos à colonização bacteriana. O primeiro obstáculo com que as bactérias se deparam é terem de conseguir aderir a tecidos banhados em fluidos. Este passo é tão importante que é considerado um determinante ecológico em termos de colonização da cavidade oral (3). Para além desta barreira as bactérias têm de ser capazes de ultrapassar as acções promovidas pelos cuidados de higiene oral e a oposição do sistema imunitário do hospedeiro (1).
A adesão é um processo complexo que em termos bacterianos se traduz na capacidade de formação de biofilmes. Estes biofilmes são constituídos por células procarióticas rodeadas de uma matriz extracelular de biomoléculas (2). A formação de biofilmes é afectada por vários factores de natureza química e física da superfície a aderir, pelas características das bactérias e pelos metabolitos presentes no meio, que afectam a interacção entre as adesinas bacterianas e os receptores membranares das células alvo. Um exemplo disso é a interacção entre os resíduos de ácido sálico da aglutinina presente na saliva humana e a proteína membranar SSP-5 do S. sanguis(2).
Apesar de todos os factores condicionantes, as bactérias são capazes de aderir devido a uma grande variedade de mecanismos de adesão como fímbrias, lipopolissacarídeos e substâncias poliméricas extracelulares que possibilitam a formação de biofilmes que, por sua vez fornecem o acesso a nutrientes, dando protecção do ambiente e permitindo rápida adaptabilidade (4), além de se protegerem das defesas do hospedeiro e da acção de antibacterianos (2). As bactérias capazes de aderir à cavidade oral e de desenvolver biofilmes podem ser divididas em dois grupos: colonizadores iniciais, bactérias capazes de aderir à película protectora de mucinas existente na superfície dos dentes (ex.Streptococcus, Hemophilus, Neisseria e Veillonella) e colonizadores secundários, bactérias que vão aderir ao biofilme em formação (5). O fenómeno que origina a colonização secundária é denominado de co-agregação ou adesão bactéria-bactéria e representa um papel crucial no desenvolvimento dos biofilmes (3).
Uma vez estabelecidos os biofilmes, estes vão manter-se relativamente estáveis sobrevivendo a alterações frequentes no meio ambiente que os rodeia, mas quando se verificam alterações na sua ecologia, levando á predominância de uma ou mais estirpes relativamente a outras, tal pode induzir ao aparecimento de patologias orais.
O objectivo deste trabalho é rever a literatura existente e determinar o estado da arte sob o ponto de vista microbiológico em relação aos materiais disponíveis no tratamento das patologias periodontais e pulpar e periapicais, nomeadamente: colutórios, soluções irrigadoras, medicação intracanalar, cones de guta-percha e cimentos de obturação.
Etiopatogenia da doença periodontal
A doença periodontal tem como origem uma associação multifactorial complexa e ainda indefinida, quanto à sua progressão e severidade. Os microrganismos do biofilme que formam a placa bacteriana são agentes extremamente importantes para iniciar a doença, porém não são totalmente responsáveis pela agressividade ocorrida nos tecidos periodontais. Os factores locais e sistémicos que podem modificar a evolução desta doença são responsáveis pelo desequilíbrio entre o hospedeiro e os microrganismos, comprometendo a resposta imunológica. As doenças ou alterações de ordem sistémica, como diabetes, patologias cardiovasculares, patologias pulmonares, distúrbios hormonais e outras, não iniciam a doença periodontal mas podem acelerar uma doença pré-existente aumentando a sua progressão e destruição tecidual (6).
Gengivite
A acumulação de placa está correlacionada com a gengivite, numa relação de causa-efeito. Embora os estudos demonstrem que são poucas as situações de gengivite capazes de desenvolver periodontite, a sua prevenção é ainda o primeiro passo na prevenção da periodontite. A transição de gengivite para periodontite pode dever-se mais do que a uma acumulação de placa, interferindo também outros factores como a idade do indivíduo, o tipo de resposta inflamatória e as características genéticas.
Periodontite
A periodontite, considerada durante muitos anos como resultado de uma infecção é actualmente vista como uma complexa inter-relação entre a infecção bacteriana e a resposta do hospedeiro, frequentemente modificada por factores comportamentais. A resposta do hospedeiro é o factor chave na expressão clínica da periodontite.
Enquanto há uma relação causal nítida entre a má higiene oral e a gengivite, em relação à periodontite a relação não é linear. A higiene oral pode ter influência na população microbiana de bolsas pequenas a moderadas mas tem pouco efeito na população microbiana de bolsas profundas (7).
Estudos mostram que em populações com má higiene oral, a acumulação de placa e tártaro supragengival está pouco relacionada com o desenvolvimento de periodontite severa. Os microrganismos geralmente implicados na doença periodontal são anaeróbias Gram negativos. Recentemente os grupos predominantes incluem Actinomyces actinomycetemcomitans (Aa), Bacteroides Forsythus (Bf) (actualmente Tannerella forsythensis), Porphyrmonas gingivalis (Pg), Prevotella intermédia (Pi), Fusobacterium nucleatum, Campylobacter rectus e Treponema denticola (8).
Alguns destes microrganismos, supostamente patogénicos, podem estabelecer-se logo na idade jovem. Presentes no sulco gengival estão intimamente associados com a periodontite. Contudo, quando presentes na placa supragengival podem constituir um reservatório natural para os primeiros. Quando o nível de agressão bacteriana sobrepõe a resposta do hospedeiro, as bactérias da placa supragengival migram formando o biofilme subgengival.(7)
A Halitose
A halitose, embora não seja considerada uma doença, produz um estigma social.(9) A sua etiologia pode ser oral ou não oral.(10) No caso da etiologia oral, a sua patogénese está associada com a degradação de bactérias contendo compostos sulfurosos voláteis.(11) Além disso, a salivação diminuída durante o sono, natural ou induzida pelos efeitos secundários de alguns medicamentos, favorece a proliferação bacteriana o que aumenta a presença de compostos sulfurosos voláteis. O tratamento mais eficaz parece focar-se na redução do revestimento bacteriano da língua e também na prevenção e/ou redução da gengivite e periodontite.(8)
A importância da saliva
A saliva possui factores importantes para a ecologia oral, para a formação de biofilmes e para a saúde oral (12). Presentes na saliva, as mucinas vão ter um papel fundamental na protecção dos dentes da colonização bacteriana. (13) A elevada concentração de Imunoglobulina A (IgA), a presença, em concentrações mais baixas, de Imunoglobina G e Imunoglobina M, a presença de enzimas como a lisozima, peroxidase e lactoferrina e o papel do fluxo salivar na remoção e arrastamento de partículas (14) conferem a importante função da saliva na defesa da cavidade oral.
Actualmente existem vários estudos relativos à adesão na cavidade oral desde o de Li e Ellen (3) que demonstra que a existência de uma colonização inicial por P. gingivalis potencia a colonização secundária de outras estirpes. Outros autores (12) defendem que a adesão bacteriana pode potenciar ou diminuir a possibilidade de desenvolvimento de cáries dentárias, advogando assim que a constituição ecológica de um biofilme tem influência no aparecimento de doenças orais. Considerando também o de Haase et al. (4) que demonstra a influência de factores ambientais na formação de biofilmes de A. actinomycetemcomitans e terminando no estudo de Murray et al. (15) que demonstra a preponderância dos componentes salivares na capacidade de adesão de estirpes de Streptococcus orais.
Tratamento da doença periodontal
A terapia periodontal tem como objectivo preservar a dentição, atrasando e revertendo a destruição periodontal e prevenindo a recorrência da doença. O tratamento periodontal inclui a remoção mecânica do biofilme, supra e infragengival, e técnicas cirúrgicas regenerativas sofisticadas, combinado com administração de antibióticos sistémicos e locais específicos para cada grupo de pacientes (16).
Um bom tratamento periodontal deve incluir tartarectomia, de modo a remover o biofilme devendo esta acção preceder a terapêutica antimicrobiana. Em primeiro lugar deve-se diminuir o número de bactérias, caso contrário, podem inibir ou degradar o agente antimicrobiano. Os agregados bacterianos devem ser desorganizados mecanicamente no início do tratamento, uma vez que podem proteger as bactérias contra os agentes activos (16,17).
A presença de placa visível e cálculos não é por si só sinal de desenvolvimento de doença periodontal. Actualmente, a presença subgengival de microrganismos patogénicos específicos como o Aa, Pi, Pg e Tf associados a outros indicadores mostraram ter um grau moderado de previsibilidade. A resposta do hospedeiro, nomeadamente, a predisposição genética e os hábitos tabágicos, são os factores de maior relevo (7).
Actividade anti-microbiana no tratamento peridodontal
A antibioticoterapia poderá ser benéfica tanto no tratamento como na prevenção da periodontite crónica, tendo sido demonstrada uma diminuição na perda de dentes e na necessidade de tratamento cirúrgico em pacientes com periodontite grave. (18)
No tratamento de uma periodontite crónica coloca-se a questão se a tartarectomia e o alisamento radicular, por si só, são suficientes, ou se existe benefício para o doente em recorrer a terapia anti-microbiana coadjuvante (19,20).
O uso de antibioticoterapia poderá ser um aliado útil à terapia mecânica. É reconhecido que antibióticos administrados sistemicamente podem ter efeitos benéficos nos parâmetros clínicos da doença periodontal, (16,20,21) sendo excepcionalmente eficazes na supressão de microorganismos cuja eliminação é difícil utilizando apenas os meios mecânicos. Também através de antibioticoterapia local, como tratamento coadjuvante da terapia convencional, é possível reduzir o risco de desenvolvimento de resistências, uma vez que se consegue obter uma grande concentração no fluído crevicular, evitando a exposição de bactérias a concentrações sub-inibitórias por um longo período de tempo, factor fundamental para o desenvolvimento de resistências (22).
Colutórios
Alguns estudos (23-30) avaliaram os agentes químicos em relação ao controlo mecânico da placa bacteriana. De acordo com estes estudos, há forte evidência do benefício do uso de agentes químicos associados a métodos mecânicos de escovagem e fio dentário, no controlo da placa bacteriana e na prevenção da gengivite.
Há múltiplos produtos antigengivite e antiplaca disponíveis sob a forma de dentífricos e colutórios, envolvendo triclosan, fluoreto de estanho, combinação de óleos essenciais, cloreto de cetilpiridínio, gluconato de clorohexidina e delmopinol. (27-29) Formulações distintas dos mesmos agentes activos podem ter diferentes níveis de eficácia.
A clorohexidina apresenta propriedades que a coloca em papel de destaque na efectividade da acção anti-placa e anti-gengivite em comparação com os restantes agentes químicos, podendo ser utilizada, com segurança, em diversas situações clínicas (31). Com um amplo espectro de acção, actua sobre bactérias Gram-positivas, Gram-negativas, fungos, leveduras e vírus lipofílicos. A sua acção bactericida inicial, imediatamente depois do bochecho, combinada com uma acção bacteriostática prolongada, devido à sua propriedade de substantividade, torna esta substância muito efectiva no controlo bacteriano da flora presente na doença peridontal. Algumas substâncias químicas como o cálcio, agentes aniónicos e flúor podem influenciar as ligações da clorohexidina, reduzindo sua retenção e a sua actividade antibacteriana. (32)
Contudo são vários os efeitos adversos associados ao uso prolongado de clorohexidina. Entres eles a pigmentação dentária, de restaurações, próteses e língua, as alterações do paladar e, raramente, a tumefacção reversível nos lábios ou glândulas parótidas, descamações na mucosa oral, urticária, dispnéia e choque anafilático (33, 34, 35, 36).
Assim, torna-se necessário o aparecimento de agentes químicos alternativos que possam oferecer um melhor balanço entre a efectividade e a tolerância dos mesmos.
Etiopatogenia das lesões pulpares e periapicais
Quando surge uma solução de continuidade, resultante de uma lesão de cárie ou traumatismo, a polpa, ou mais frequentemente os túbulos dentinários, ficam sujeitos à acção dos microrganismos e seus produtos metabólicos. Está hoje bem demonstrado o papel fundamental dos microrganismos na etiologia das lesões pulpares e periapicais (37,38). Uma infecção da polpa pode, por sua vez, resultar na colonização microbiana de todo o sistema de canais radiculares, incluindo os túbulos dentinários. Estas infecções são geralmente mistas, predominando os microrganismos anaeróbios (39). Estes microrganismos e seus produtos metabólicos são responsáveis pelo desenvolvimento e persistência de lesões periapicais de origem endodôntica.
A forma como os microrganismos penetram no canal radicular, permanecendo viáveis por longos períodos no ambiente desfavorável de um canal radicular, por vezes já obturado, e multiplicando-se, é importante, estando em causa a formação do biofilme apical, relacionado com a perpetuação destas infecções (40). A população microbiana associada ao fracasso do tratamento endodontico é composta predominantemente por bactérias gram-positivas anaeróbias facultativas (41-45). A população microbiana envolvida em infecções radiculares primárias é distinta da população microbiana isolada nas infecções secundárias, tanto qualitativamente, em termos de variabilidade de espécies, quanto quantitativamente (46).
Tratamento das lesões pulpares e periapicais
O factor microbiológico é apontado como causa importante de fracasso do tratamento endodontico. A análise de bactérias localizadas na porção apical permite perceber que estas estão numa posição estratégica para induzir dano ao tecido periapical, resultando em doença inflamatória (47,48). A cirurgia periapical e a análise microbiológica do material removido permitem, por vezes, a identificação de bactérias como o Propionibacterium acnes, que aparece envolvido no insucesso endodôntico (49,50). Estreptococos, enterococos e lactobacilos podem ser identificados em dentes com sinais clínicos e radiográficos de periodontite apical (51,52). Os autores encontraram microrganismos residuais na região apical de dentes tratados em sessão única e entendem que tal situação se deve à alta complexidade do sistema de canais radiculares que não permite uma limpeza efectiva, nem mesmo após o uso de técnicas de instrumentação mecânica e soluções irrigadoras antimicrobianas. Estão também descritas situações de actinomicose extra-radicular associadas à infecção endodôntica (53).
Tratamento endodontico
A eliminação dos microrganismos dos canais radiculares é assim crucial e um dos principais objectivos do tratamento destas lesões. Este tratamento, denominado tratamento endodôntico radical, envolve 2 fases iniciais fundamentais: a mecânica, constituída pela instrumentação dos canais e a química, de actuação de soluções de irrigação e eventual colocação de produtos anti-microbianos nos canais radiculares.
A terapêutica endodontica envolve assim um esforço considerável na remoção dos microrganismos dos canais radiculares. O profissional deve, ainda, estar preocupado não só com a população microbiana endógena mas também com a contaminação bacteriana exógena que pode ocorrer durante ou após o tratamento. A 3ª fase do tratamento endodôntico, após a instrumentação e irrigação e, nalguns casos, a desinfecção dos canais entre sessões de tratamento, é a obturação do sistema de canais radiculares, a qual deve ser o mais hermética possível e tridimensional, selando eficazmente, coronal e apicalmente, o canal. A obturação definitiva do sistema de canais radiculares deverá eliminar os espaços vazios perpetuando a desinfecção obtida após a preparação biomecânica e reduzindo os riscos potenciais de re-infecção.
Cirurgia Apical
É inegável a constante evolução na Endodontia ao longo dos anos, levando a tratamentos com taxas de sucessos cada vez mais altos.
No entanto, apesar de toda a evolução os tratamentos dos canais radiculares estão sujeitos a falhas e a variadas complicações durante a sua execução clínica.
Perante um caso em que o tratamento endodontico falhou, existe a possibilidade de retratamento, porém nem sempre esta conduta é viável, restando-nos a cirurgia apical como uma alternativa. Podemos ter lesões periapicais refractárias, canais calcificados com lesões periapicais onde o acesso via câmara pulpar é impossível, instrumentos fracturados, perfurações apicais, degraus e outras situações onde o tratamento endodontico convencional não dispõe de recursos para tratar o caso com sucesso.
Perante todas estas situações a cirurgia periapical apresenta-se como um tratamento alternativo de resolver e contornar os problemas que não conseguimos solucionar através do tratamento endodontico radical convencional. (54)
Anti-microbianos no tratamento endodôntico
Soluções irrigadoras
A utilização de substâncias químicas durante a preparação biomecânica do canal radicular assume especial importância na desinfecção e limpeza do sistema de canais radiculares. É importante ressaltar que a substância química utilizada durante a preparação deve conter propriedades que permitam as acções bactericida e solvente tecidual.
A preparação químico mecânica é, sem dúvida, de importância singular para o sucesso do tratamento endodôntico. Associada à instrumentação mecânica dos canais utilizam-se soluções irrigadoras antibacterianas, sendo a mais frequente, a solução de hipoclorito de sódio. Contudo a sua eficácia depende da concentração e do tempo de actuação exibindo, por vezes, as concentrações necessárias alguma toxicidade para os tecidos periapicais.
Várias soluções, como hipoclorito de sódio, EDTA, ácido cítrico, clorexidina e outras, têm sido usadas como substâncias auxiliares da instrumentação, no entanto o irrigante ideal ainda não foi encontrado. (55) A solução de hipoclorito de sódio tem sido a substância química mais utilizada na irrigação de canais radiculares. Várias propriedades lhe têm sido atribuídas, tais como: acção solvente de matéria orgânica; lubrificante; desodorizante e actividade antimicrobiana. (56, 57)
Em virtude do seu poder citotóxico, recomenda-se a utilização de soluções menos concentradas.
Medicação intracanalar
É recomendado por vários autores a colocação de uma medicação intracanalar. Entre estes produtos, a pasta de hidróxido de cálcio tem sido a mais utilizada, sendo aconselhada a sua colocação nos canais radiculares, entre as sessões de tratamento, devido à marcada actividade anti-bacteriana demonstrada sobre a maioria das espécies identificadas nas infecções endodônticas (58,59,60). A pasta de hidróxido de cálcio é uma escolha quase universal dada a sua alcalinidade, o que lhe confere a actividade anti-microbiana.
Contudo, no caso de infecções que resistem ao tratamento endodôntico convencional, onde tem sido implicados microrganismos como o Enterococcus faecalis e a Candida albicans, o hidróxido de cálcio não mostra a eficácia habitual (42,43,61,62). Além disso, estudos recentes (63) referem que a exposição prolongada (mais de 180 dias) da dentina radicular aos efeitos do hidróxido de cálcio poderá afectar as suas características físicas, com possíveis implicações clínicas para os dentes tratados, nomeadamente uma maior susceptibilidade a fracturas a longo prazo (64,65).
Cones de guta-percha
Não menos importante, após a fase de preparação biomecânica, é a qualidade da obturação do sistema de canais radiculares que visa o selamento de vestígios de irritantes no sistema canalar e a minimização dos efeitos nocivos de uma eventual infiltração apical e coronal. Os cones de guta-percha são um material de obturação usado na terapêutica endodontica há mais de 100 anos. São compostos por componentes orgânicos (polímeros de guta-percha e resinas) e inorgânicos (óxido de zinco e sulfato de bário) (66). Na prática endodontica, a desinfecção dos cones de guta-percha é um dos elos da cadeia asséptica e, consequentemente, tem implicações no sucesso da terapêutica.
Os cones de guta-percha podem ser facilmente contaminados por uma variedade de microrganismos, tais como: cocos, bacilos e leveduras, após exposição ao ambiente de trabalho (67) e, assim, serem uma fonte de contaminação quando introduzidos nos canais radiculares. Como a guta-percha não pode ser esterilizada pela autoclavagem convencional ou pela estufa de ar seco, requer uma descontaminação rápida, antes do seu uso, para manter a cadeia asséptica.
Vários agentes descontaminantes têm sido propostos (68-71). Um dos mais frequentemente indicados, a solução de hipoclorito de sódio (NaOCl), sendo um forte agente oxidante reduz a estabilidade química das cadeias de polímeros, levando à deterioração da estrutura dos cones de guta-percha (72). Valois (72), observou a topografia da porção apical dos cones de guta-percha, usando o microscópio de força atómica, observando irregularidades morfológicas na sua superfície, particularmente na porção apical. A presença destas pode representar um risco aumentado de fracasso da obturação, uma vez que a dimensão delas é compatível com o tamanho das proteínas e produtos bacterianos, o que pode realçar a importância da desinfecção dos cones de guta-percha antes da sua introdução nos canais radiculares. Outro aspecto negativo da desinfecção com hipoclorito de sódio é que podem ficar cristais à superfície dos cones, impedindo um bom selamento quando da obturação (73). Há ainda agentes que são eficazes mas necessitam de muito tempo de actuação, pouco compatível com o protocolo clínico (69).
Cimentos de obturação
Além da preservação da assepsia dos cones de guta-percha procura-se evitar outras falhas da cadeia asséptica e da incapacidade de eliminar todos os microrganismos dos canais radiculares, durante a sua preparação, bem como a falta de adesão dos ditos cones (74) às paredes dos canais. Para isso, associam-se cimentos na obturação. Os cimentos auxiliam os cones no preenchimento dos canais, sendo os agentes responsáveis pela adesividade, podendo em alguns casos, possuir também propriedades bactericidas ou bacteriostáticas. (75, 76, 77)
Grossman (78) enumerou os requisitos e as características de um bom cimento de canais radiculares, entre eles ter uma boa adesão entre o material e a parede do canal, promover um selamento hermético, ser radiopaco, não alterar a cor do dente, não sofrer contracção ao tomar presa, ser insolúvel nos fluidos tecidulares, ser bem tolerado pelos tecidos, ser solúvel por um solvente comum (caso seja necessário a sua remoção), não deve provocar uma reacção imunitária nos tecidos periapicais, não deve ser mutagénico nem cariogénico.
E, porque actualmente não existem cimentos nem técnicas que garantam o selamento adequado de todo o sistema canalar, o cimento deve, pelo menos, aprisionar os microrganismos remanescentes, de forma a evitar o seu acesso aos tecidos periradiculares (79). Vários estudos estão documentados onde se faz a avaliação da eficácia de diferentes cimentos contra os diferentes microrganismos da flora endodontica, cariogénica ou da saliva, e os resultados demonstram a falta de um padrão de resposta ao tratamento (80-83). A necessidade destes estudos é assim real, sugerindo que quando não existe resposta positiva ao tratamento endodontico, é necessária uma amostragem bacteriológica com o objectivo de identificar o (s) agente (s) alvo e assim apoiar a escolha terapêutica (84).
Os cimentos mais utilizados são os de óxido de zinco e eugenol e seus semelhantes mas também os cimentos de hidróxido de cálcio, cimentos à base de ionómero de vidro e de resinas têm vindo a tornar-se populares (54). Novos materiais à base de resinas, por exemplo, têm surgido para tentar obter melhor selamento. Contudo, todos eles têm problemas de filtração, variável de acordo com o produto comercial, devido principalmente à contracção de polimerização, além da maior dificuldade da sua remoção, em certos casos, quando há necessidade de efectuar um retratamento.
De acordo com vários autores (85,86), os cimentos devem eliminar a interface entre a guta-percha e as paredes do canal radicular. No entanto, independentemente do material utilizado, ocorre sempre um certo grau de infiltração, entre o cimento e a dentina e entre o cimento e a guta-percha, além da que acontece através do cimento propriamente dito e devido à dissolução do mesmo (87).
Vários métodos experimentais têm sido utilizados para avaliar a microfiltração após a obturação, incluindo radioisótopos, corantes, bactérias, proteínas e endotoxinas. Nestas metodologias foram utilizadas várias técnicas in vitro e períodos experimentais que, produziram resultados controversos. Apesar de algum cepticismo quanto aos resultados dos estudos de infiltração in vitro, na perspectiva clínica e das suas limitações, bem como na comparação dos mesmos com diferentes métodos experimentais, estes estudos são amplamente utilizados na avaliação e comparação do comportamento dos cimentos existentes (88-90). Ainda assim, a microfiltração, tanto a nível coronal como apical, continua a ser matéria de investigação pois, mesmo com os avanços ocorridos na área da endodontia e das crescentes taxas de sucesso alcançado, continua a haver insucessos clínicos. Muitas destas situações são maioritariamente atribuídas à proliferação bacteriana que persiste viável, mesmo após a preparação biomecânica, causando irritação dos tecidos periapicais. A falta de selamento completo promovido pelos cimentos de obturação pode ter origem na sua composição química e nas propriedades físicas (adesividade, estabilidade dimensional, fluidez, solubilidade). Actualmente, nenhum cimento disponível satisfaz todos os critérios.
No entanto, as técnicas de obturação, a possível presença de smear layer e/ou de canais acessórios e os próprios erros técnicos são também, certamente, factores responsáveis pela perda de selamento (91).
Conclusão
A actividade antimicrobiana dos diferentes materiais utilizados na abordagem das patologias periodontais e pulpares/periapicais, para os diferentes microrganismos, varia de acordo com os testes usados, a técnica e o tempo de avaliação utilizados nos estudos microbiológicos. É inquestionável as divergências dos resultados experimentais. No entanto, todos eles apresentam componentes antimicrobianos mas sem efeito bacteriano residual permanente. Actualmente, não há nenhum material disponível no mercado que satisfaça todos os critérios considerados ideais e com actividade antimicrobiana eficaz.
Bibliografia
•1- Gibbons RJ. Bacterial Adhesion to Oral Tissues: A Model for Infectious Diseases. J Dent Res 1989; 68:750-760.
•2- An Y, Friedman R. Handbook of bacterial adhesion, 1ST Edition, Humana Press, New Jersey 2000.
•3- Li J, Ellen RP. Relative adherence of Bacteroides Species and Strains to Actinomyces viscosus on saliva-coated Hydrixyapatite. J Dent Res 1989; 68(9): 1308-12.
•4- Haase E, Bonstein T, Palmer Jr. RJ; Scannapieco F. Environmental influences on Actinobacillus actinomycetemcomitans biofilm formation. Arch Oral Biol 2006; 51(4): 299-314.
•5- Bryers JD, Ratner BD. Biomaterials approaches to combating oral biofilms and dental disease. Oral Health 2006; 15; 6 suppl 15.
•6- Santos GE, Santos RL, Silveira RCJ, Souza, EHA. Clinical and systemic evaluation of patients seeking periodontal treatment. Revista Odonto Ciência – Fac. Odonto/PUCRS 2005; 20 (49):199-203.
•7- Academy Report. Epidemiology of periodontal disease. J Periodontol 2005; 76(8): 1406-1419.
•8- Ximenez-Fyvie LA, Haffajee AD, Socransky SS. Microbiological composition of supra and subgingival plaque in subjects with adult periodontitis. J Clin Periodontol 2000; 27: 722-732.
•9- Faveri M, Hayacibara MF, Pupio GC, Cury JA, Tsuki CO, Hayacibara RM. Therapeutic approaches to morning breath odour. J Clin Periodontol 2006; 33: 555-560.
•10- Sreenivasan P. The effects of a triclosan/copolymer dentifrice on oral bacteria including those producing hydrogen sulphide. Eur J Oral Sci 2003; 111: 223-227.
•11- De Boever EH, Lesche WJ. Assessing the contribution of anaerobic microflora of the tongue to malodour. J Am Dent Assoc 1995; 126: 1384-1393.
•12- Stenudd C, Nordlund A, Ryberg M, Johansson I, Kallestai C, Strömberg N. The Association of Bacterial Adhesion with Dental Caries. J Dent Res 2005; 80:2005-2010.
•13- Prescott L, Harley J, Klein D. (2005) Microbiology 6ª ed, McGraw-Hill, Nova Iorque.
•14- Arosa F, Cardoso E, Pacheco F. Fundamentos de Imunologia, Lidel, Lisboa 2007.
•15- Murray P, Akraporn P, Lee T, Hoover C, Fisher S. Adherence of Oral Streptococci to Salivary Glycoproteins. Infect Immun 1992; 60: 31-38.
•16- López NJ, Socransky SS, Da Silva I, Japlit MR, Haffajee AD. Effects of metronidazole plus amoxicillin as the only therapy on the microbiological and clinical parameters of untreated choronic periodontitis. J Clin Periodontol 2006; 33:648-660.
•17- Addy M, Martin MV. Systemic antimicrobials in the treatment of chronic periodontal diseases: a dilemma. Oral diseases 2003; 9:38-44.
•18- Jorgenson MG, Safarian A, Daneshmand N, Keim RJ, Slots J. Initial effect of controlled-release doxycycline inn subgengival sites. J Periodont Res. 2004, 39; 315-319.
•19- Bonito AJ, Lux L, Lohr KN. Impact of local adjuncts to scaling and root planing in periodontal disease therapy: a systematic review. J Periodontol. 2005, 76(8):1227-36.
•20- Breault LG, Spadar SE. Local chemotherapeutics as an adjunct to scaling and root planing. Dent Assist. 2004, 73(6):20, 22-24.
•21- Ciancio S G: Systemic medications: clinical significance in periodontics. J Clin Periodontol 2002; 29 (suppl 2): 17-21.
•22- Rodrigues RM, Goncalves C, Souto R, Feres-Filho EJ, Uzeda M, Colombo AP. Antibiotic resistance profile of the subgingival microbiota following systemic or local tetracycline therapy. J Clin Periodontol 2004; 31(6):420-7.
•23- Basrani B, Lemonie C. Chlorhexidine gluconate. Aust Endod J. 2005; 31: 48-52.
•24- Addy M, Wade WG, Jenkins S, Goodfield S. Comparison of two commercially available chlorhexidine mouthrinses: I. staining and antimicrobial effects in vitro. Clin Prev Dent. 1989; 11: 10-14.
•25- Garcia-Godoy F, Ellacuria J. Effectiveness of Sonicare power tootbrush to remove chlorhexidine stains. Am J Dent. 2002; 15: 290-292.
•26- Addy M, Martin MV. Systemic antimicrobials in the treatment of chronic periodontal diseases: a dilemma.Oral Dis 2003; 9 Suppl 1:38-44.
•27- Addy M, Moran J, Newcombe RG. Meta-analyses of studies of 0.2% delmopinol mouth rinse as an adjunct to gingival health and plaque control measures. J Clin Periodontol 2007;34(1):58-65.
•28- Sreenivasan P, Gaffar A. Antiplaque biocides and bacterial resistance: a review. J Clin Periodontol 2002; 29(11):965-74.
•29- Gunsolley JC. A meta-analysis of six-month studies of antiplaque and antigingivitis agents. J Am Dent Assoc 2006; 137(12):1649-1657.
•30- Walsh TF. Mouthrinses as adjuncts in periodontal therapy. Dent Update 1996; 23:144-147.
•31- Jones CG. Chlorhexidine: is it still the gold standard? Periodontol 2000. 1997; 15: 55-62.
•32- Barkvoll P, Rölla G, Svendsen K. Interaction between chlorhexidine digluconate and sodium lauryl sulfate in vivo. J Clin Periodontol. 1989;16(9):593-5.
•33- Zanatta FB, Rösing CK. Clorexidina: mecanismo de ação e evidências atuais de sua eficácia no contexto do biofilme supragengival. Scientific-A 2007;1(2): 35-43.
•34- Addy M, Mahdavi SA, Loyn T. Dietary staining in vitro by mouthrinses as a comparative measure of antiseptic activity and predictor of staining in vivo. J Dent. 1995; 23: 95-99.
•35- Carpenter GH, Pramanik R, Proctor GB. An in vitro model of chlorhexidine-induced tooth staining. J. Periodontal Res. 2005; 40: 225-230.
•36- Francetti l, Del Fabbro M, Basso M, Testori T, Taschieri S, Weinstein R. Chlorhexidine spray versus mouthwash in the control of dental plaque after implant surgery. J Clin Periodontol. 2004; 31: 857-862.
•37- Kakeashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and convencional laboratotry rats. Oral Surg Oral Med Oral Pathol 1965; 20: 340-9.
•38- Sundqvist G. Bacteriological studies of necrotic dental pulps. Umeå, Sweden: University of Umeå, 1976.
•39- Siqueira JF Jr, Rôças IN. Campylobacter gracilis and Campylobacter rectus in primary endodontic infections. Int End J 2003; 36: 174-180.
•40- Siqueira JF Jr. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J. 2001 Jan;34(1):1-10.
•41- Hancock, H. H.; Sigurdsson, A.; Trope, M.; Moiseiwitsch, J. Bacteria isolated after unsuccessful endodontic treatment in a North American population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001; 91: 579-86.
•42- Pinheiro ET, Gomes BP, Ferraz CC, Teixeira FB, Zaia AA, Souza-Filho FJ. Evaluation of root canal microorganisms isolated from teeth with endodontic failure and their antimicrobial susceptibility. Oral Microbiol Immunol, 2003; 18(2):100-103.
•43- Pinheiro ET, Gomes BP, Ferraz CC, Sousa EL, Teixeira FB, Souza-Filho FJ. Microorganisms from canals of root-filled teeth with periapical lesions. Int Endod J, 2003; 36(1):1-11.
•44- Adib V, Spratt D, Ng, Y-L, Gulabilava K. Cultivable microbial flora associated with persistent periapical disease and coronal leakage after root canal treatment: a preliminary study. Int End J 2004; 37(8): 542-551.
•45- Chávez de Paz LE, Molander A, Dahlén G. Gram-positive rods prevailing in teeth with periodontites undergoing root canal treatment. Int Endod J, 2004:37(9): 579-87.
•46- Gomes BP, Pinheiro ET, Gade-Neto CR, Souza EL, Ferraz CC, Zaia AA, Teixeira FB, Souza-Filho FJ. Microbiological examination on infected dental roots canals. Oral Microbiol Immunol, 2004; 19:71-6.
•47- Nair PN, Sjögren U, Figdor D, Sundqvist G. Persistent periapical radiolucencies of root-filled human teeth, failed endodontic treatments, and periapical scars. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 1999; 87: 617-27.
•48- Nair PN, Sjögren U, Krey G, Kahnberg KE, Sundqvist G. Intraradicular bacteria and fungi in root-filled, asymptomatic human teeth with therapy-resistant periapical lesions: a long-term light and electron microscopic follow-up study. J Endod, 1990; 16: 580-588.
•49- Debelian GJ, Olsen I, Tronstad L. Profiling of Propionibacterium acnes recovered from root canal and blood during and after endodontic treatment. Endod Dent Traumatol 1992; 8: 248-54.
•50- Ferreira FB, Ferreira AL, Gomes BP, Souza-Filho FJ. Resolution of persistent periapical infection by endodontic surgery. Int Endod J 2004; 37: 61-69.
•51- Chávez de Paz LE, Dahlén G, Molander A, Bergenholtz G. Bacteria recovered from teeth with apical periodontitis after antimicrobial endodontic treatment. Int Endod J 2003; 36: 500-508.
•52- Nair PN, Stephane H, Cano V, Vera J. Microbial status of apical root canal system of human mandibular first molars with primary apical periodontitis after «one-visit» endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99: 231-52.
•53- Ricucci D, Siqueira Jr JF. Apical actinomycosis as a continuum of intraradicular and extraradicular infection: case report and critical review on its involvement with treatment failure. J Endod 2008; 34:1124-9.
•54- COHEN. Pathways of the Pulp. 9TH Edition. Mosby 2006.
•55- Gomes BPFA. Microrganismos: Quais são? Onde estão? Que danos causam? In: Cardoso RJA, Gonçalves EAN. Odontologia: endodontia e trauma. [S.l.]: Artes Médicas; 2002. v. 2, p. 77-97.
•56- Foley DB. Effectiveness of selected irrigants in the elimination of Bacteroides melaninogenicus from the root canal system: an in vitro study. J Endodon. 1983; 9:236-41.
•57- Georgopoulou M. Evaluation of the antimicrobial effectiveness of citric acid and sodium hypochlorite on the anaerobic flora of the infected root canal. Int Endod J. 1994; 27:139-43.
•58- Fava LRG, Saunders WP. Calcium hydroxide pastes: classification and clinical indications. Int End J 1999; 32:257-282.
•59- Morrier JJ, Barsotti O. Antimicrobial activity of Ca(OH)2 dental cements: an in vitro study. J. Endod. 2003; 29: 51-54.
•60- Abdulkader A, Duguid R, Saunders EM. The antimicrobial activity of endodontic sealers to anaerobic bacteria. Int. Endod J 1996; 29: 280-283.
•61- Love RM. Enterococcus faecalis – a mechanism for its role in endodontic failure. Int Endod J 2001; 34: 399-405.
•62- Cwikla SJ, Bélanger M, Giguère S, Progulske-Fox A, Vertucci FJ. Dentinal tubule disinfection using three calcium hydroxide formulations. J Endod 2005; 31(1): 50-52.
•63- Doyon GE, Dumsha T, von Fraunhofer JA. Fracture resistance of human root dentin exposed to intracanal calcium hydroxide. J Endod 2005; 31(12): 895-897.
•64- Andreasen JO, Kristerson L. The effect of extra-alveolar root filling with calcium hydroxide on periodontal healing after replantation of permanent incisors in monkeys. J Endod 1981; 7: 349-354.
•65- Andreasen JO, Farik B, Munksgaard EC. Long-term calcium hydroxide as a root canal dressing may increase risk of root fracture. End Dent Traumatol 2002; 18: 134-137.
•66- Gurgel-Filho ED, Andrade Feitosa JP, Teixeira FB, Monteiro de Paula RC, Araújo Silva JB Jr, Souza-Filho FJ. Chemical and X-ray analyses of five brands of dental gutta-percha cone. Int Endod J 2003; 36: 302-7.
•67- Linke HAB, Chohayeb AA. Effective surface sterilization of gutta-percha points. Oral Surg Oral Med Oral Pathol 1983; 55: 73-77.
•68- Cardoso CL, Kotaka CR, Redmerski R, Guilhermetti M, Queiroz A. Rapid decontamination of gutta-percha cones with sodium hypochlorite. J End 1999; 25: 498-501.
•69- Motta PG, Figueiredo CB, Maltos SM, Nicoli JR, Ribeiro Sobrinho AP, Maltos KL, Carvalhais HP. Efficacy of chemical sterilization and storage conditions of gutta-percha cones. Int Endod J 2001; 34(6): 435-439.
•70- Siqueira JFJr, Pereira da Silva CHF, Cerqueira MDO, Lopes HP, Uzeda M. Effectiveness of four chemical solutions in eliminating Bacillus subtilis spores on gutta-percha cones. Endod Dental Traumatol 1998; 14: 124-6.
•71- Pina-Vaz I, Espinar MJ, Noites R, Carvalho MF. In vitro evaluation of the antimicrobial activity of different antiseptics on contaminated gutta-percha cones. Rev Clin Pesq Odontol 2008; 4(3): 153-159.
•72- Valois CRA, Silva LP, Azevedo RB. Structural effects of sodium hypochlorite solutions on gutta-percha cones: atomic force microscopic study. J Endod 2005; 31(10): 749-751.
•73- Short RD, Dorn SO, Kuttler S. The crystallization of sodium hypochlorite on gutta-percha cones after the rapid-sterilization technique: an SEM study. J Endod 2003; 29: 670-673.
•74- Spangberg L, Langeland K. Biologic effects of dental material. Toxicity of root canal filling materials on HeLa calls in vitro. Oral Surg Oral Med Oral Pathol 1973; 35: 402-14.
•75- Pizzo G, Giammanco GM, Cumbo E, Nicolosi G, Gallina G. In vitro antibacterial activity of endodontic sealers. J Dent 2006; 34:35-40.
•76- Tanomaru-Filho M, Tanomaru JM, Barros DB, Watanabe E, Ito IY. In vitro antimicrobial activity of endodontic sealers, MTA-based cements and Portland cement. J Oral Sci 2007; 49:41-45.
•77- Slutzky-Goldberg I, Slutzky H, Solomonov M, Moshonov J, Weiss EI, Matalon S. Antibacterial Properties of Four Endodontic Sealers. J Endod 2008;34:735-738.
•78- WEINE. Endodontic Therapy. 6TH Edition. Mosby 2004.
•79- Siqueira JF, Rôças IN, Favieri A, Abad EC, Castro AJR, Gahyva SM. Bacterial leakage in coronally unsealed root canals obturated with 3 different techniques. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90: 647-650.
•80- Slutzky-Goldberg I, Slutzky H, Solomonov M, Moshonov J, Weiss EI, Matalon S. Antibacterial Properties of Four Endodontic Sealers. J Endod 2008;34: 735-738.
•81- Miyagak DC, Carvalho EM, Robazza CR, Chavasco JK, Levorato GL. In vitro evaluation of the antimicrobial activity of endodontic sealers. Braz Oral Res 2006; 20:303-306.
•82- Yasuda Y, Kamaguchi A, Saito T. In vitro evaluation of the antimicrobial activity of a new resin-based endodontic sealer against endodontic pathogens. J Oral Sci 2008; 50(3):309-313.
•83- Kaplan AE, Picca M, Gonzalez MI, Macchi RL, Molgatini SL. Antimicrobial effect of six endodontic sealers: an in vitro evaluation. Endod Dent Traumatol 1999; 15:42-45.
•84- Morrier JJ, Benay G, Hartmann C, Barsotti O. Antimicrobial activity of Ca(OH)2 dental cements: an in vitro study. J Endod. 2003 Jan; 29(1):51-54.
•85- Timpawat S, Amornchat C, Trisuwan WR. Bacterial Coronal leakage after obturation with three root canal sealers. J Endod 2001; 27: 36-39.
•86- Veríssimo DM, Sampaio do Vale M. Methodologies for assessment of apical and coronal leakage of endodontic filling materials: a critical review. Journal of Oral Science 2006; 48(3): 93-98.
•87- Hovland EJ, Dumsha TC. Leakage evaluation in vitro of the root canal sealer cement Sealapex. Int Endod J. 1985; 18(3):179-82.
•88- Wu M-K, Wesselink PR. Endodontic leakage studies reconsidered. Part I. Methodology, application and relevance. Int Endodont J 1993; 26: 37-43.
•89- Dandakis C, Kalica M, Lambrianidis T, Kosti E. An in vitro comparison of the sealing ability of three endodontic sealers used in canals with iatrogenic enlargement of the apical constriction. J Endod 2005; 31(3); 190-193.
•90- De Almeida WA, Leonardo MR, Tanomaru FM, Silva LAB. Evaluation of apical sealing of three endodontic sealers. Int Endod J 2000; 33:25.
•91- Sevimay S, Kalayci A. Evaluation of apical sealing ability and adaptation to dentine of two resin based sealers. J Oral Rehabil 2005; 32: 105-110.
Oral paracoccidioidomycosis. A clinical case
Article`s Title: ORAL PARACOCCIDIOIDOMYCOSIS. A CLINICAL CASE
Running Title:OralParacoccidioidomycosis
Key words: paracoccidioidomycosis, oral mucosa, swelling.
Authorsname:(1)FILIPE COIMBRA
(2)ANA LANHAS LOPES
(3)Elaine Massucato
(4)Ricardo Faria Almeida
(5)Fontes de Carvalho
(6)António Felino
AcademicPost: (1) Assistant Professor, Faculdade de Medicina Dentária da Universidade do Porto, Portugal.
(2) MedicalDentist, Faculdade de Medicina Dentária da Universidade do Porto, Portugal.
(3) Assistant Professor, Faculdade de Odontologia de Araraquara, Brasil.
(4) Associated Professor, Faculdade de Medicina Dentária da Universidade do Porto, Portugal.
(5)Associated Professor, Faculdade de Medicina Dentária da Universidade do Porto, Portugal.
(6) Catedratic Professor, Faculdade de Medicina Dentária da Universidade do Porto, Portugal.
Mailing address. Rua Nossa Senhora da Hora, 65, 4430-182, Vila Nova de Gaia, Portugal
Telefhone Number: +351962492386
e-mail address: filipepacoimbra@gmail.com
SUMMARY
A middle-aged man complaining of a hard swelling of the oral mucosa of the inferior lip and persistent dry cough was studied by one of us during a visit to theBrazilian Town of Araraquara in the State of S. Paulo. The patient was a laborer with smoking and drinking habits. Long yeast cells with multiple branches were detected at microscopic examination of material scrapped from the mucosal swelling and after further cultures in Sabouraud`s agar. Blood serum double Immunodiffusion and crossimmunoelectrophoresis techniques showed positive reactions against purified antigens extracted from Paracoccidioidesbrasiliensis. Oral administration of Itraconazol led to marked improvement of the oral symptoms. Since this infection can persist for years in human carriers, it is important that the dental practitioner may suspect of its presence in patients comingto Portugal or Spain from South America.
Introduction
Paracoccidioidomycosis(PCM) is a fungal infection caused by Paracoccidioidesbrasiliensis occurring in Central and South America.In Brazil it predominates in the Southern States namely S. Paulo, Minas Gerais, Rio de Janeiro, Paraná and Rio Grande do Sul(1).The agentlives free on the earthly ground, contaminating humans by inhalation of the spores and giving rise to pulmonary infections that may spread through the lymphatic or bloodroutesto lymph nodes, mouth, skin and adrenal glands(1,2,3,4).
Most frequent is the chronic form occurring in male agricultural laborers over thirty-years old, living in bad social conditions associated with malnutrition, alcoholism or over-smoking(5).Clinical symptoms are usually delayed appearing years after contamination when patients have moved to urban centers(2,6). They then often exhibit a dry, persistent cough anddyspnea(3,7), but oral lesions may also occur as the first symptom, located in lips, the oral mucosa, palate and tongue(1,4,8),appearing as swollen mucosal areas sometimes ulcerated. The acute form is present in children or young adolescents of both genders, and If not early detected it may quickly assume serious proportions involving lungs, the tegument, lymph nodes, the lymphatic organs of the digestive tract, spleen, liver and lungs (9,10).
Our purpose in the present work is to present a clinical case of chronic PCM. Since cases have been reported abroad in patients having visited South American countries11, it may be useful to know this pathology in Portugal and Spain.
CASE REPORT
H.Z., a male widowbrick-layer,53 years old, of Caucasian ascent, born in Araraquara (S. Paulo, Brazil), smoker and alcoholic for 30 years, was seen by one of us (Ana Lopes) in the Department of Oral Medicine of the Faculty of Odontology of Araraquara, complaining of a tooth fall one month ago, that was followed by the development of a spongy mass in the tooth cavity. The neighboring inferior lip was swollenand insensitive. (Fig.1). There was a burning sensation in the oral cavity and persistent dry cough.
The mucosal surface of the posterior face of the left lower lip was swollen and hardenedwith a reticulated appearancedue to the presence of scattered bleeding points and fissures, extending laterally from the oral commissure for a 7 cm. length to the jugal mucosa (Fig. 2).A firm spherical pediculated mass, 1.5 cm. in diameter, occupied the place of teeth 37 and 38.Very bad oral hygiene with loss of various teeth.Material scrapped from the affected mucosa wasdirectly examined or cultured in Sabouraud’s agar. In both cases, long yeast cells with multiple budding were observed under the microscope (Fig.3).In blood serumdouble-immunodifusion (ID) showed positive reaction to an antigenic preparation of P. brasiliensis and negative reactions toward HistoplasmacapsulatumorA. fumigatus. With the crossed-immunoelectrophoresis (CIE) technique results were likewise positive only for P. brasilirensis(1/26 sensitivity). Lung X-rays showed interstitial fibrosis in the form of butterfly wings. The pediculated growth appeared under the microscope as a typical posttraumatic fibroma.
Treatmentconsisted of a daily pill of Itraconazol, 200 mg during 15 days, after which there was a marked improvement of the oral lesions. The medication was maintained, and extensive dental care was carried out with extraction of various teeth. Although there was complete regression of local edema, the white color of the mucosa persisted.
DISCUSSION
This was a typical case of PCMwith involvement of the lung which is usually the primary location in this condition in accordance with the airborne fungal penetration (1,3,4). Lungs are exclusively affected in 25% of the diagnosed patients at the beginning of the infection but are also lesioned in 90% of the multifocal presentations in which the agent has contaminated other organs through blood or lymphatic routes(1,2,7). This probably happened with this patient, a brick-layer for many years working in contact with the soil though being not an agricultural laborer. It may be noted that rareunifocal presentations in the oralregion may occur given the habit of chewing leaves or tooth picking using short branches of plants (12). Direct contamination from person to person or congenitally from parents has never been observe
The infection is usually acquired between 10 and 20 years of age, remaining silent until after the patient reaches the third decade. The reactivation is then due to smoking or drinking habits, or a diminished immunity often seen in people living in precarious conditions (7,13). Curiously females are less affected (one woman for 10-25 males) which has been explained by the occurrence of estrogen membrane receptors in the parasite. When activated such receptors do prevent the conversion of the hyphalform occurring in soil into the pathogenic yeast form within body tissues (8).In this present clinical case the lesion of the lip mucosa was, as usual, of the hypertrophic type but devoid of ulceration as sometimes occurs (4). If left untreated the inflammatory process may invade the rest of the mouth inner lining. Palatal lesions have the danger of propagation to the underlying palatal bone(12).
As here shown, examination of scrapped material was enough to detect the fungus(15), so that biopsy is usually superfluous. When the latter is performed, histological examination of Grocott-Gomorimethenamine-silver preparations reveals the presence of large black stained yeasts within the cytoplasm of multinucleated giant cells surrounded by multiple spores (4).Serological methods are also mandatory since both ID and CIE have a sensitivity which varies between 85 and 100 % in the pre-treatment stage. In addition, antibody titration of blood serum correlates withthe seriousness of the illness, although its predictive value diminishes a little in the follow-up during treatment (4).
As to the medication there are three drug options, amphotericine B (a polyene anti-fungal agent), sulfadiazine (a sulfonamide derivative) and the azolic compounds (14). The latter are the most effective in mild-to-moderate cases with preference for Itraconazol (14), which in this case had a prompt ameliorative action. It should be taken for at least three months and the patient must beseen every six months thereafter, with serological control to insure the virtual eradication of the mycosis.But it should be noted that total cure is problematic given the tendency of the yeast to remain dormant in the body. Therefore follow-up is recommended for some years ahead.
In a non-endemic region like Portugal or Spain, the here described clinical symptoms should lead the dental practioner to suspect of other pathologies such as lung tuberculosis or sarcoidosis in which cough and X-ray lesions may coincide with oral alterations (6). On the other hand the occurrence of a persistent lip enlargement is frequent in orofacialgranulomatosis (6). In all these cases, local biopsy is necessary. If however the patient came from a country in which fungal infections are endemic PMC should be taken into consideration.
REFERENCES
1.Martins GB, Salum FG, Figueiredo MAS, Cherubini K, Yurgel LS. Paracoccidioidomicose bucal Relato de 3 casos.BraPatol oral 2003 Jul-Set;2(3):22-28.
2. Shikanai-Yasuda MA, Telles filho FQ, Mendes RP, Colombo AL, Moretti ML. Guidelinesinparacoccidioidomicose. RevSocBrasMedTrop. 2006 May-Jun;39(3).297-310.
3.Oliveira Mo, Pistóia AD, Neuhaus C, Veiga Fb. A paracoccidioidomicose na odontologia. Relato de um caso. Saúde 2005; 31 (1-2):10-15.
4. Silvio AM. Paracoccidioidomicose: Atualização epidemiológica, clínica e terapêutica.BrasDermatol78(2):134-150, Mar-Abr.2003.
5. PaniagoAm, Aguiar JI,Aguiar ES, Cunha RV,Pereira GR, Londero AT, Wank B. Paracoccidioidomicose:a clinicalandepidemiologicalstudyof 422 casesobservedin Mato Grosso do Sul.SocBrasMedTrop. 2003 Jul-Aug;36(4).455-9.
6.Palmeiro M, Cherubini K, Yurgel LS. Paracoccidioidomicose-LiteratureReview. Scientia Medica. 2005 Out-Dez;15(4):274-8.
7.Pedroso VS,Vilela C, Pedroso ER, Teixeira AL Paracoccidioidomicosiscompromisingthe central nervoussystem: a reviewoftheliterature. SocBrasMedTrop. 2009 Dec,42(6):692-7.
8.Vieira EMM, Borsatto-Galera B.Manifestações clínicas bucais da paracoccidioidomicose. PatolTrop 2006Jan-Abr;35(1):23-30.
9,Meneses-Garcia A, Mosqueda-Taylor A, Moralesdela Luz R, Rivera LM.Paracoccidioidomicose: reportof 2 cases mimicking scamous cell carcinoma. Oral Surg Oral Pathol Oral RadiolEndod.2002 Nov;94(5):609-13.
10.Ribeiro LC, Hahn RC, Favalessa OC, Tadano T, Fontes CJ. Systemic mycosis:factors associated with death among patients infected with the immunodeficiency virus, Cuiabá, State of MatoGrosso, Brazil, 2005-2008. Rev Soc Bras Med Trop. 2009 Dec;42(6):698-705.
11.Bousquet A, DussartC,Drouillar I, Charbel EC, Boiron P. Imported mycosis. A review of paracoccidioidomycosis. Med Mal infect. 2007 Dec; 37 Suppl 3:S210-4.
12. Castro LGM, Muller AP, Migliari DA. Hard palate perforation: anunusual finding in paracoccidioidomycosis. Int J dermatol 2001:40(4):281:83.
13, Bisinelli JC, Telles FQ, Sobrinho JA, Rapoport A. StomatologicalManifestationsofParacoccidioidomycosis.Bras Otorrinolaringol.2001 Sep;67(6):683-7.
14. Bicalho RN, Santo MF, Aguiar MC, Santos VR. Oral Paracoccidioidomycosis: a retrospective study of 62 Brazilian patients. Oral Dis. 2001 Jan;7(1):56-60.
15.Talhari C, de Sousa JV, Parreira VJ, Reinel D. Talhri S. Oral exfoliativecytology as a rapiddiagnostictool for Paracoccidioidomycosis. Mycoses. 2008 Mar;51(2):177-8.

Regeneración osteomucosa con membrana de quitosano: Reporte de un caso.
REGENERACIÓN OSTEOMUCOSA CON MEMBRANA DE QUITOSANO: REPORTE DE UN CASO.
Dubraska Suárez1, Carlos García 2, Jenair Yépez 3, Anajulia González 4, Gladys Velazco 5.
Facultad de Odontología, Calle 23 entre avenidas 2 y 3, Departamento de Investigación, Universidad de Los Andes (ULA), Mérida-Venezuela. Telef.: 0274-2402379. E-mail: gvelazco@ula.ve
- Universidad de Los Andes. Facultad de Odontología. Departamento de Investigación.
- Universidad de Los Andes. Facultad de Odontología. Centro de Investigaciones Odontológicas.
- Universidad de Los Andes. Facultad de Odontología. Cátedra de Cirugía Bucal
- Universidad de Los Andes. Facultad de Odontología. Laboratorio Integrado de Biología Celular y Molecular (LIBCEM).
- Universidad de Los Andes. Facultad de Odontología. Cátedra de Biomateriales Dentales.
RESUMEN
La regeneración osteomucosa guiada (ROG) usando membranas de quitosano, excluye células del epitelio gingival y conectivo en el proceso de cicatrización, favoreciendo la regeneración mediante principios activos y un correcto ordenamiento del tejido regenerado. Objetivo: Valorar clínica, citológica y radiográficamente una lesión osteomucosa tratada con membrana de quitosano. Presentación del caso: Paciente femenina de 18 años, sistémicamente sana a la que se le realizó una cirugía de los terceros molares inferiores retenidos. Para la ROG se hidrató una membrana de quitosano en solución fisiológica, y se cubrió el alveólo derecho con ella. A los 8 días se retiró la sutura y se realizó citología exfoliativa de ambas zonas. Se tomaron fotografías a los 15 días y al mes. También se realizaron radiografías panorámicas, a los 15 días, mes y a los 7 meses postquirúrgicos. Resultados: A los 8 días se observó la zona izquierda con dehiscencia de la herida, empaquetamiento de alimentos, mientras que en el lado derecho, fue menor el grado de inflamación y eritema, mejor cicatrización y escaza acumulación de placa. Al mes la mucosa en el lado derecho presentó óptimos signos de cicatrización, mientras que en izquierdo persistió acumulación de placa bacteriana. Radiográficamente, a los 15 días, en el lado derecho se observó continuidad de la zona intervenida con el hueso circundante y escaza aposición mineral. Al mes la densidad mineral fue Moderada (50 y 80 % del defecto). A los 7 meses postoperatorios la aposición mineral fue Abundante (mayor al 80 %). La citología Clase I Papanicolau del lado derecho evidenció porciones aisladas de la membrana de quitosano desprendidas, escasos elementos epiteliales aislados, sin evidencia de componentes inflamatorios. Conclusión: Los resultados obtenidos indican que el alveólo tratado con quitosano regeneró más rápido y el proceso inflamatorio fue menos agresivo que en el lado no tratado.
Palabras Claves: Regeneración ósea, membranas, quitosano.
BONE AND TISSUE REGENERATION WITH CHITOSAN MEMBRANE: A CASE REPORT.
ABSTRACT
Guided bone and mucous membrane regeneration (GBR) using membranes of chitosan, excludes gingival epithelial cells and connective healing, promoting regeneration through active and proper ordering of the regenerated tissue. Objective: To evaluate clinical, cytological and radiographic bone and mucous injury treated with chitosan membrane. Case presentation: Female patient 18 years old, which systemically healthy subjects underwent surgery retained mandibular third molars. For the GBR was hydrated chitosan membrane in saline, and covered her right socket. At 8 days, suture removal and cytology was performed in both areas. Photographs were taken at 15 days and a month. Panoramic radiographs were also performed at 15 days, months and 7 months postoperative. Results: After eight days left side was observed with wound dehiscence, food packaging, while on the right side was lower the degree of swelling and erythema, better healing and scarce accumulation of plaque. Mucosal month on the right side showed signs of healing optimal, while left plaque accumulation persisted. Radiographically, after 15 days, on the right side was observed continuity of the surgical site with the surrounding bone mineral apposition and scarce. A month mineral density was moderate (50 and 80% of default). At 7 months postoperatively was abundant mineral apposition (greater than 80%). The Pap smear Class I on the right side showed isolated portions of the chitosan membrane detached, few isolated epithelial elements, without evidence of inflammatory components. Conclusion: Our results indicate that the alveolus treated with chitosan regenerated faster and the inflammatory process was less aggressive than in the untreated side.
Keywords: bone regeneration, membranes, chitosan.
Introducción
Los defectos óseos en los maxilares pueden ocurrir por diversas razones tumores, quistes, infecciones o sencillamente defectos en alvéolos post exodoncia que representan el grueso de los defectos más comunes. Es por ello que actualmente, es más frecuente la necesidad de acudir a las terapias regenerativas o colocar sustitutos óseos, como tratamiento previo a la colocación de un implante dental o la colocación de protésis.
Dependiendo del tamaño del defecto, la regeneración autóloga podrá ocurrir a integridad. Pero el reemplazo del defecto por tejido conectivo es una limitación común de la cicatrización de los defectos óseos en los maxilares, ya que interfiere provocando inestabilidad y limitaciones funcionales y anatómicas 1.
La regeneración ósea guiada (ROG) es una terapia que viene a resolver el problema planteado anteriormente, cuya finalidad es inducir la regeneración de defectos óseos o mantener el nivel óseo ya existente en zonas edéntulas. Se fundamenta en la utilización de sistemas barrera mediante membranas que aislan un determinado defecto óseo, excluyendo células provenientes del epitelio gingival y el tejido conectivo en el proceso de cicatrización 2. Estas membranas pueden ser reabsorbibles y no reabsorbibles, siendo las no reabsorbibles las que presentan mayores inconvenientes ya que tienen que ser retiradas tiempo después de la cirugía y es frecuente que se expongan e infecten3.
La membrana que se use para esta terapia idealmente debe cumplir con los siguientes requisitos1: biocompatible, impermeable[1], debe mantener el espacio suficiente en el cual el tejido óseo neoformado pueda crecer y la regeneración pueda ocurrir. La membrana debe ser manejable y tener la capacidad de integración con los tejidos vecinos.
Todos estos requisitos han sido difíciles de obtener con las membranas disponibles en el mercado, sin mencionar el alto costo que implican y la desventaja que tienen dichos biomateriales al no actuar como una verdadera barrera biológica. Por otro lado, y en relación a la oclusividad, la membrana además de actuar como barrera, la misma debería permitir un cierto grado de permeabilidad y presentar una superficie porosa, ya que esto propicia la adhesión celular y el intercambio de fluídos y de gases con el medio.
Es decir, la mayoría de las membranas disponibles en el mercado y comúnmente usadas para la regeneración tisular guiada (RTG) y ROG, actúan como un apósito pasivo impidiendo el intercambio con el medio ambiente; sólo protegen, aíslan y rellenan. Sin embargo, el quitosano es un biomaterial bioactivo, lo que significa que promueve la curación de las heridas por liberación de productos biológicos asociados a él (glucosamina, plasma rico en plaquetas entre otros), además el quitosano por si mismo se comporta como una de tales productos biológicos. 4.
Para compensar un poco las desventajas que acompañan el uso de los sistemas de barrera disponibles, se han desarrollado las membranas de quitosano (polímero natural compuesto por cadenas de N-acetilglucosamina). Estas cadenas son reabsorbibles, de origen natural u orgánico, ya que proceden de la desacetilación de la quitina (componente principal del caparazón de los crustáceos, paredes celulares de hongos y de insectos).
El quitosano es biocompatible y biodegradable 5,6 (por la lisozima y otras enzimas proteolíticas). Ejerce una función antimicrobiana 7, cicatrizante de heridas 8, analgésico( ya que absorbe un ion protonado presente en el sitio del dolor y la quitina absorbe la bradikinina enzima importante en la producción de dolor)9, además posee un efecto hemostático 10, antiviral 11, antitumoral 12 e inmunoadyuvante 13, propiedades por las cuales el quitosano ha sido ampliamente utilizado en la ingeniería de tejido óseo. Además, en estudios realizados in vitro y ensayos preclínicos en animales, el quitosano ha demostrado que promueve el crecimiento óseo14.
La combinación de quitosano con factores de crecimiento presentes en el plasma de pacientes que van a ser tratados con la terapia de ROG, le proporciona al material la característica de convertirse en un Scaffold implantable (Andamio o matriz que funge como malla donde tiene lugar la adhesión y proliferación celular a medida que se biodegrada), promoviendo la formación de tejido nuevo 15, 16,17.
Las sales de quitosano, producto de la desacetilación termoalcalina de las conchas de camarón, han sido usadas con seguridad en seres humanos bajo la norma ASTM.F 2103-01[2], pero no así como biomaterial para la ROG en odontología. En tal sentido se planteó la utilización de biomembranas para tratar defectos óseos postquirúrgicos, las cuales fueron elaboradas en el Centro de Investigaciones Odontológicas de la Universidad de Los Andes (CIO-ULA) (ver figura 1), siguiendo el protocolo planteado por Velazco y cols.4. El presente caso clínico describe, la utilización y valoración de la respuesta osteomucosa posterior a la exodoncia de terceros molares incluídos.
Objetivo: Comparar la evolución clínica, histológica y radiográfica de una lesión osteomucosa tratada con Quitosano en contraste con una lesión tratada convencionalmente.
Presentación del caso
Se trata de paciente femenina de 18 años de edad, quien acude a la consulta para extraerse los terceros molares inferiores, por motivos ortodónticos. Al interrogatorio, la paciente no manifestó antecedentes personales de enfermedades sistémicas. Al examen clínico, se observó gingivitis leve generalizada; restauraciones en buen estado en 36, 37; y apiñamiento dentario anterosuperior y anteroinferior, como hallazgos de importancia. Los exámenes de laboratorio complementarios arrojaron resultados estables y dentro de los valores normales para el acto quirúrgico.
Al examen radiográfico, se observaron imágenes mixtas (radiolúcidas y radiopacas) en zona retromolar inferior y superior, compatibles con terceros molares retenidos.
Previa a la intervención quirúrgica, la paciente firmó el consentimiento informado. La secuencia quirúrgica fue la siguiente: asepsia y antisepsia del campo operatorio con Clorhexidina al 0.12%, realización de la odontectomía bajo anestesia local troncular mandibular indirecta para el nervio dentario inferior e infiltrativa para el nervio bucal largo, con Lidocaína al 2%. Seguidamente, se efectuó una incisión de Winter modificada con alivio mesiovestibular en ambas zonas de la cirugía, con posterior levantamiento del colgajo mucoperióstico, osteotomía, localización de la pieza dentaria a extraer, odontosección y exodoncia propiamente dicha con elevadores. Seguidamente, se realizó la limpieza de la zona con solución fisiológica, hidratación de la membrana de quitosano de 2cm en solución fisiológica, colocación la misma cubriendo la zona alveolar remanente (figura 2), reposicionamiento del colgajo y sutura discontinua a puntos simples, empleando hilo de seda negra 3-0. Una vez culminado el procedimiento, se le dieron las indicaciones postoperatorias a la paciente y se le indicó tratamiento antibiótico y antiinflamatorio (Amoxicilina 500mg, 1 tableta cada 8 horas por 5 días; Ibuprofeno 400mg, 1 tableta cada 8 horas por 6 días).
Se realizó el seguimiento clínico del caso con fotografías postoperatorias inmediatas, a los 15 días y al mes, evaluando cualitativamente los signos de inflamación y cicatrización de las zonas quirúrgicas. De igual forma, se realizaron controles con radiografías panorámicas, a los 15 días, al mes y a los 7 meses postquirúrgicos, verificando los siguientes criterios de regeneración ósea: Continuidad radiográfica de la zona intervenida con el hueso circundante: (0= No,1= Si) y Cantidad de la aposición mineral: (0=Densidad en la cavidad ósea que cubre menos del 50 % del defecto o Escasa ,1=Densidad en la cavidad ósea que cubre entre el 50 y 80 % del defecto o Moderada, 2=Densidad en la cavidad ósea que cubre más del 80 % del defecto o Abundante)
Cabe destacar que a los 8 días postoperatorios se retiraron los puntos de sutura y se tomó una muestra por raspado con cepillo para citología (figura 3), en ambas zonas inferiores, con la finalidad de determinar la presencia o ausencia de cambios microscópicos en las células descamadas de la mucosa.
Resultados
En la valoración clínica, a los 8 días, se observó la mucosa del área correspondiente al tercer molar inferior izquierdo (área no tratada con la membrana) con dehiscencia de la herida, empaquetamiento de alimentos (figura 4). Por su parte, la mucosa del lado derecho (tratada con quitosano), presentó un menor grado de inflamación y eritema, mejor cicatrización y baja acumulación de placa bacteriana (Figura 5). Al mes postquirúrgico, el lado inferior tratado con quitosano, reveló una mucosa con óptimos signos de cicatrización, mientras que en el lado no tratado se observaron los bordes de la cicatriz irregulares además de acumulación de placa bacteriana .
Respecto al control radiográfico, se presenta el siguiente cuadro resumen:
Cuadro 1. Resultados de la evaluación del grado de regeneración ósea.
|
Criterio Radiográfico
Período |
Continuidad radiográfica con el hueso circundante |
Cantidad de aposición mineral |
||
|
|
|
|
|
|
|
15 días |
1 |
1 |
0 |
0 |
|
1 Mes |
1 |
1 |
1 |
0 |
|
7 Meses |
1 |
1 |
2 |
1 |
Fuente: Los autores.
LEYENDA:
Alvéolo tratado con Con Quitosano
Alvéolo sin Quitosano
Continuidad radiográfica de la zona intervenida con el hueso circundante:
No = 0
Si = 1
Cantidad de la aposición mineral:
0= Escasa (menos del 50%),
1= Moderada (Entre 50 y 80%)
2= Abundante (más del 80 % del defecto)
En el cuadro 1 se evidencia que en ambos lados existió continuidad radiográfica con el hueso circundante, pero la cantidad de la aposición mineral fue mayor y más rápida en la zona tratada con quitosano que en la izquierda.
Al cabo de 1 mes en el defecto óseo tratado con quitosano (figura 6), se observó aposición mineral moderada (Entre el 50 y 80 % del defecto), mientras que en el defecto izquierdo la densidad ósea cubría menos del 50% del área (figura 7). A los 7 meses la densidad ósea era abundante en el defecto con quitosano (figura 8) y en el defecto izquierdo moderada.(figura 9)
En lo concerniente a los resultados de la citología exfoliativa (papanicolau), en la zona tratada con quitosano se observó una citología Clase I, con evidencia de mínimos rastros aislados de la membrana de quitosano desprendidas (en la mucosa derecha), escasos elementos epiteliales aislados, sin evidencia de componentes inflamatorios (Figura 10). Mientras que en el lado no tratado se observó una mayor cantidad de elementos epiteliales, compatibles con un proceso inflamatorio (Figura 11).
Discusión
A pesar que en el examen citológico no se observaron diferencias importantes entre ambos defectos. Para el momento de la toma de la muestra clínicamente el lado izquierdo se observó más inflamado que el lado tratado con quitosano, el cual mostró una mejor cicatrización de la herida.
En el momento de colocación de la membrana, se pudo evidenciar una mejor respuesta hemostática de la herida alveolar. Este efecto hemostático ya ha sido descrito debido a una interacción entre la membrana celular de los eritrocitos y el quitosano, siendo esta interacción independiente de la cascada clásica de la coagulación 12.
La disminución de la inflamación y mejoría superior del lado tratado con quitosano puede atribuirse, por un lado a su capacidad de responder a un cambio de pH de ligeramente ácido a pH fisiológico18, y por el otro, y al actuar como un policatión, se une con mayor facilidad a las células y en particular al imidazol el cual inhibe a la tromboxano sintetasa, actuando como buffer, antioxidante y facilitando el proceso de cicatrización de los tejidos.
Los parámetros radiográficos para verificar la regeneración ósea, indicaron que el defecto tratado con quitosano fue mayor y más rápida la remineralización, por lo cual se confirma el efecto osteogénico y osteoinductor que se le ha adjudicado al quitosano19.
La respuesta ósea observada en este caso clínico coincide con la observada en un experimento realizado en humanos, en el cual se demostró que las membranas de quitosano con tecnología de nanofibra podían incrementar la regeneración ósea sin presentar ningún signo de reacción inflamatoria 14. Así mismo coincide con los resultados observados en investigaciones realizadas sobre animales de laboratorio20. El incremento de la regeneración ósea puede deberse a la propiedad osteoconductora del quitosano, el cual estimula la síntesis de colágeno tipo I, facilitando la diferenciación de células osteogénicas.20.
Al igual que en este caso clínico, otras investigaciones confirman que la membrana de quitosano es biocompatible al incrementar la regeneración ósea y no generar reacciones inflamatorias adversas 14,5.
La biocompatibilidad de las membranas de quitosano también es explicada por su origen natural, ya que todos los biomateriales producidos a partir de materias primas que provienen de la naturaleza han demostrado mejorar la promoción de la curación a un ritmo más rápido y mayor compatibilidad con los seres humanos. Entonces, resulta sumamente importante para la biocompatibilidad y biodegradación que el biomaterial a implantar tenga una topografía de superficie porosa, que permita en principio la colonización celular y a medida que aumenta la proliferación celular desaparezca la matriz 21.
Finalmente, tanto los resultados del presente caso y de otros estudios, representan evidencias clínicas de que la regeneración tisular asistida por membranas de quitosano, puede consttituir una importante técnica en odontología, que abre la posibilidad de estudiar ampliamente sus aplicaciones, especialmente en cirugía bucal y periodoncia, como material para elaborar membranas periodontales, matrices para el trasporte de fármacos y liberación de factores de crecimiento, formación de compuestos con otros materiales y minerales para injertos y rellenos óseos, entre otros 5,22 .
Conclusiones
El alveólo tratado con quitosano regeneró más rápido y el proceso inflamatorio fue menos agresivo que en el lado no tratado. Por tanto, la membrana de quitosano se pudiera considerar para ser colocada en defectos óseos postoperatorios entre otros, actuando como un andamio o scaffold para la ingeniería de tejidos in vivo .Se recomienda valorar la eficiencia de dicha membrana para la regeneración ósea mediante estudios prospectivos.
Referencias Bibliográficas
•1. De la Rosa GM y col. Regeneración ósea guiada de cara al año 2000. Revista ADM 2000; 57 (4): 147-153
•2. Massimo M, y cols. Vertical ridge augmentation using a membrane technique associated with osseointegrated implants. Int J Periodont Rest Dent1994; 14: 497-511.
•3. Simion M, Baldoni M, Rossi P, Zaffe D. A comparative study of the effectiveness of e-PTFE membranes with and without early exposure during the healing period. Int J Periodontics Restorative Dent 1994; 14: 166-80.
•4. Velazco, G., Ortiz, R., González, A. Nuevas terapéuticas para regeneración ósea a base de hidroxiapatita y quitosano. Acta Microscópica. 2011; 20 (Supp. A): 1-4. Disponible en: http://actamicroscopica.ivic.gob.ve/V20_1_2011/CONVEMI%202010%20(Supp.%20A)/index.html
•5. Jorquera R., Jorquera O., Rivera S. Quitosano: un Material con Propiedades Regenerativas y su Aplicación Clínica. Rev Eur Odontoestomatol. 2008. Disponible en: http://www.redoe.com/ver.php?id=100&highlight=quitosano
•6. Carhuapoma, L. Bernabé, J. Santiago 2,3. Caracterizacion de hidrogeles de quitosano-alcoholpolivinilico obtenidos por radiación gamma. Rev. Iberoam. Polim. 6(4), (2005).
•7. Rosero, M. Estudio de los biomateriales para el desarrollo de endoprotesis. [tesis]. Ingeniería Mecánica y Mecatrónica. Universidad Nacional de Colombia; 2003: 101-102.
•8. Sanz J, Garcia J, Doblare M. On scaffold designing for bone regeneration: a computational multiscale approach. Acta Biomaterial. 2009; 5(9): 219-29.
•9. Seol YJ, Lee JY, Park YJ, Lee YM, Young-Ku, Rhyu IC, Lee SJ, Han SB, Chung CP. Chitosan sponges as tissue engineering scaffolds for bone formation. Biotechnol Lett 2004; 26: 1037-41.
•10. Shen E, Chou T, Gau C, Tu H, Chen Y. Releasing growth factors from activated human platelets after chitosan stimulation: a possible bio-material for platelet-rich plasma preparation. Clinical Oral Implants Research. 2006; 17(5): 572-578.
•11. Ishihara C., et al., Anti-viral activity of sulfated chitin derivatives against Friend murine leukaemia and herpes simplex type-1 viruses. Vaccine. 1993; 11(6): 670-674.
•12. Qin C, Du Y, Xiao L, Li Z, Gao X. Enzymic preparation of water-soluble chitosan and their antitumor activity. Int. J. Biol. Macromol. 2002; 31(1-3): 111-117.
•13. Marcinkiewicz J, Polewska A, Knapczyk J. Immunoadjuvant properties of chitosan. Arch. Immunol. 1991; 39(1-2): 127-132.
•14. Seung S, Park H, Chong C. Biological evaluation of chitosan nanofifer membrane for guided bone regeneration. J Periodontol. 2005; 7(6): 1778-1784
•15. Elisseeff M. Scaffolding in tissue engineering. LA: CRC Press Taylor & Francis Group; B. Baum, D. Mooney. The impact of tissue engineering on dentistry. J Am Dent Assoc.2006; 10 (31): 309-318.
•16. Shen E, Chou T, Gau C, Tu H, Chen Y. Releasing growth factors from activated human platelets after chitosan stimulation: a possible bio-material for platelet-rich plasma preparation. Clinical Oral Implants Research. 2006; 17(5): 572-578.
•17. Hua Y., Ning C., Xiaoying L., Buzhong Z., Wei C., Xiaoling S. Natural hydroxyapatite/chitosan composite for bone substitute materials. Engineering in Medicine and Biology Society. 2006; 4(8): 88-91.
•18. Zhang Y, Ni M, Zhang M, Ratner B. Calcium phosphatechitosan composite scaffolds for bone tissue engineering. Tissue Eng. 2003; 9: 337-45.
•19. Lee JY, Nam SH, Im SY, Park YJ, Lee YM, Seol YJ, Chung CP, Lee SJ. Enhanced bone formation by controlled growth factor delivery from chitosan-based biomaterials. J Control Release 2002; 78:187-97.
•20. Eun P, Jeong P. Effects of chitosan on human periodontal fibroblasts in vitro and on bone formation in rat calvarial defects. J. Periodontol. 2005; 7(6): 526-533.
•21. Du, C. Apatite/amelogenin coating on titanium promotes osteogenic gene expression. J Dent Res. 2005; 8(4): 1070-1074.

[1]
Es la propiedad oclusiva para prevenir que el tejido conectivo fibroso no entre al espacio cubierto por la membrana, al mismo tiempo que proteja a la herida contra una invasión bacteriana.
[2]
Las normas de la American Section of the international Association for testing materials (ASTM) constituyen una guía mundial para la estandarización en el uso de materiales y métodos para todas las industrias.
Linfoma de Burkitt: Incidencia, diagnóstico, evolución y tratamiento
Esquembri-Bescós, Noelia (1); Berini-Aytés, Leonardo (2); Gay-Escoda, Cosme (3).
(1) Odontóloga. Residente del Máster de Cirugía Bucal e Implantología Bucofacial. Facultad de Odontología de la Universidad de Barcelona. Odontólogo.
(2) Doctor en Medicina. Estomatólogo. Especialista en Cirugía Maxilofacial. Profesor titular de Patología Quirúrgica Bucal y Maxilofacial. Profesor del Máster de Cirugía Bucal e Implantología Bucofacial de la Universidad de Barcelona. Investigador del Instituto IDIBELL.
(3) Doctor en Medicina. Estomatólogo. Especialista en Cirugía Maxilofacial. Catedrático de Patología Quirúrgica Bucal y Maxilofacial. Director del Máster de Cirugía Bucal e Implantología Bucofacial. Facultad de Odontología de la Universidad de Barcelona. Investigador-coordinador del Instituto IDIBELL. Jefe del Servicio de Cirugía Bucal, Implantología Bucofacial y Cirugía Maxilofacial del Centro Médico Teknon. Barcelona.
Correspondencia:
Dr. Cosme Gay Escoda
Centro Médico Teknon
Vilana 12
08022 Barcelona
Teléfono: 93 402 42 74
Fax: 93 393 30 70
RESUMEN
Introducción: Los linfomas de la cavidad bucal corresponden a menos del 5% de los cánceres bucales. El linfoma de Burkitt (LB) es una forma de linfoma no Hodgkin (LNH) de rápido crecimiento, de alto grado de malignidad, que aparece preferentemente en niños. Existen 3 tipos: el endémico (africano), el esporádico (americano) y el tipo asociado a estadios de inmunodeficiencia. Predomina en el género masculino siendo más frecuente en la mandíbula. La etiología es desconocida, pero se ha demostrado que el virus de Epstein-Barr (VEB), el virus de la inmunodeficiencia humana (VIH) y el parásito Plasmodium falciparum están implicados en su etiopatogenia. La clínica del LB es muy variada.
Objetivos: Conocer la incidencia del LB, su distribución geográfica, clínica, evolución y tratamiento; para poder efectuar un correcto diagnóstico precoz.
Metodología: Búsqueda bibliográfica en Pubmed. Palabras clave: Burkitt’s lymphoma, non Hodgkin lymphoma, pathogenesis, early diagnosis, radiology, prognosis, treatment and oral cavity. Se obtuvieron 194 artículos. Se aplicaron los siguientes límites: idioma (español, inglés y francés), estudios efectuados en humanos y publicados en los últimos 15 años, obteniendo 167 artículos. De éstos se seleccionaron 59 artículos que eran correctos metodológicamente.
Resultados y Discusión: El diagnóstico de presunción precoz se basa fundamentalmente en una buena historia clínica. La exploración clínica general permite identificar adenopatías, alteraciones abdominales y/o afectación del estado general, ayudándonos de exploraciones complementarias como la radiografía de tórax, la tomografía computadorizada o la tomografía por emisión de positrones. A nivel bucodental empleamos la ortopantomografía o las radiografías periapicales para la identificación de lesiones osteolíticas alrededor de los dientes, fractura o pérdida de las criptas y de la lámina dura, desplazamientos de gérmenes dentarios, reabsorciones radiculares, borramiento del reborde del seno maxilar y/o imágenes en «rayos de sol». El diagnóstico de certeza nos lo proporciona la biopsia que permite el estudio anatomopatológico e inmunohistoquímico.
Conclusiones: Es importante aprender a identificar cualquier patología con repercusión bucal ya que de nosotros depende hacer un diagnóstico precoz correcto, y por tanto aumentar la tasa de supervivencia de los pacientes con éste tipo de patología.
Palabras clave: Linfoma de Burkitt, linfoma no Hodgkin.
Título corto: Linfoma de Burkitt.
Burkitt’s lymphoma: Incidence, diagnosis, evolution and treatment.
ABSTRACT
Background: oral cavity lymphomas represent less than 5% of buccal cancers. Burkitt’s lymphoma (BL) is a fast-growing no-Hodgkin lymphoma, with a high malignity-grade that appears mostly in children. 3 types of BL are described: endemic (african), sporadic (american), and inmunodeficiency-related type. It ussually appears in males, and is more often seen in the mandible. Its aethiology is not clear, although it has been demonstrated that Epstein-Barr Virus (EBV), Human Inmunodeficiency Virus (HIV) and the Plasmodium Falciparum parasite are involved on it. The clinical appearance is ofted miscellaneous, with different signs and sympthoms.
Objectives: to describe the incidence of BL, its geografic distribution, clinical appearance, development and treatment, so a correct early diagnosis can be made.
Methodology: Systematic bibliografic search in PubMed. Key words: Burkitt’s lymphoma, early diagnosis and epidemiology. 194 articles were obtained. Applied limits: language (Spanish, English and French), studies made in humans and published in the last 15 years; obtaining 167 papers. Finally, 59 metodologically-correct articles were selected.
Results and Discussion: Early presumption diagnosis is maily based on a correct medical history. General clinical examination identifies adenopathies, abdominal disorders and/or systemic involvement; additional examination such as torax radiography, computerized tomography or positron emission tomography may be helpful. In our field, panoramic and/or periapical radiographies can be used for teh identification of radiolucent images surrounding teeth, bone criptae/lamina dura loss or fracture, dental germs displacement, root resorption, loss of the maxillary sinus borderline and/or «ray of light» radiographic bone images. Final diagnosis is given by the anatomopathological and inmunohistochemical analyses achieved by the biopsy of the lesion.
Conclussions: It is very important to identify any pathologic condition that may have buccal implications, for it relays on us the task of making a correct early diagnosis, increasing the survival rate of patients suffering from BL.
Key Words: Burkitt’s lymphoma, No-Hodgkin lymphoma.
Short title: Burkitt’s lymphoma.
1. INTRODUCCIÓN
El término linfoma se refiere a un grupo de tumores sólidos que afecta las células del sistema linforreticular o inmunitario, como los linfocitos B y T y los monocitos. Los linfomas de la cavidad bucal representan menos del 5% de los cánceres bucales. El carcinoma de células escamosas y las neoplasias de las glándulas salivales son los cánceres bucales más frecuentes, ocupando el primer y segundo lugar respectivamente, seguidos en tercer lugar por los linfomas (1,2).
El linfoma de Burkitt (LB), también conocido como linfoma de células B, linfoma de alto grado de células B o linfoma de células pequeñas no divididas, según la Organización Mundial de la Salud (OMS) es una forma de linfoma no Hodgkin (LNH) de rápido crecimiento, de alto grado de malignidad, indiferenciado y difuso, que aparece en niños, presentando características multifocales y afectando vísceras abdominales, pelvianas o ambas, tejidos blandos retroperitoneales, el maxilar superior y la mandíbula y los ganglios linfáticos. Es una linfoproliferación neoplásica B monoclonal con susceptibilidad para originarse en cualquier territorio con presencia de tejido linfoide (3, 4, 5).
Fue descrito en Uganda en el año 1958 por el cirujano inglés Denis Burkitt, quién observó entre la población infantil del este de África la existencia de tumoraciones que afectaban a los huesos faciales (tumores linfoides mandibulares) y al abdomen. Burkitt lo consideró un sarcoma mandibular que aparecía principalmente en niños de 14 años de edad. A partir de la década de los 60 se registran casos en los Estados Unidos de Norteamérica (EE.UU.) y Europa que presentan un patrón clínico epidemiológico diferente en relación a la forma africana y que se conoce actualmente como variante americana (6, 7).
Actualmente se acepta que existen 3 tipos de LB: el endémico (forma africana), el esporádico (forma americana) y el tipo asociado a estadios de inmunodeficiencia (8, 9). Tanto la clasificación de Murphy como la de Ziegler, ambas de 1977, son válidas para estudiar el tumor y pronosticar la respuesta al tratamiento (4, 10) (Tabla 1).
La mayoría de autores describen que el LB predomina en el género masculino en proporciones que oscilan entre 4:1 y 8:1. La incidencia dependiendo de la zona estudiada varía ampliamente, siendo de 2,4 casos/100.000 habitantes/año en Uganda o de 9,1 casos/1.000.000 habitantes/año en México. La edad media de aparición es de 4 a 6 años (2,11). La presentación del LB en edad adulta resulta atípica, viéndose favorecida por la concomitancia de estados de inmunodepresión, como el síndrome de Wiskott-Aldrich, la ataxia-telangiectásica, el síndrome de Chediak-Higashi, o el síndrome de la inmunodeficiencia humana (S.I.D.A). Este último es el estado de inmunodepresión que con mayor frecuencia se asocia al LB. Más del 95% de los casos de LNH en pacientes VIH-positivos (virus de la inmunodeficiencia humana) son de fenotipo B y tienen un grado de malignidad intermedio o alto (12).
Un estudio del Instituto de Cancerología de los EE.UU. mostró que el LB es más frecuente en la mandíbula, y de presentación unilateral. En México los datos del Instituto Nacional de Pediatría (INP) muestran que en el maxilar superior solo aparece en el 13’3% de los casos (2).
La etiología del LB es desconocida. En 1996 Epstein cultivó las células del tumor y puso en evidencia la presencia de un virus ADN, demostrando por el estudio de sus propiedades inmunológicas, que el virus de Epstein-Barr (VEB) tenía un papel etiopatogénico. El LB endémico está estrechamente asociado con el VEB, principal causante de la mononucleosis infecciosa, siendo su seroprevalencia del 98%. Por contra, la forma americana no está ligada al virus ya que solo en el 25% de los casos se relacionan con este. Además en la variante no endémica la detección de títulos elevados de anti-cápside viral parece relacionarse con un peor pronóstico de la enfermedad (13-16). Como cofactores se incluyen determinadas alteraciones cromosómicas, la malaria, defectos inmunitarios y déficits proteicos (17-19).
En pacientes VIH-positivos, el papel del agente transformador que ejerce el VEB en la forma endémica lo asume el VIH. Éste promueve la expresión de citocinas inmunoblásticas cuyas funciones redundan en la activación de los oncógenes c-myc por translocaciones, o del bcl-6 y bcl-2 por disregulaciones, sin olvidar la inactivación del antioncogen p53. Así, el VIH no influye sólo en la expansión policlonal de los linfocitos B a través de las interleucinas 6, 10 y 12, si no que aminora la respuesta al tratamiento y obliga cada vez con mayor frecuencia a efectuar abordajes quirúrgicos, hasta ahora, desaconsejados en este tipo de patología (18, 19).
2. CLÍNICA
Los autores describen 3 variantes de LB: la forma endémica (africana), la esporádica (americana) y la asociada a estadios de inmunodeficiencia.
La forma africana o endémica se caracteriza por una tumoración de rápido crecimiento presente en los maxilares casi en el 60% de los casos. La nasofaringe, la orofaringe, las gónadas o el estómago son otras localizaciones descritas en la literatura. En la infancia las zonas más afectadas son la mandíbula con un 51’6% de los casos y el abdomen con un 25% de los casos. En el 13’8% se presenta en ambas localizaciones y en el 9’6% en otras áreas. En los adultos aparece en un 43’2% de los casos en el abdomen y en un 4’5% en la mandíbula. La afectación del sistema nervioso central, de la glándula tiroides o de las glándulas salivares es más frecuente en la forma americana que en la africana (4, 9, 20, 21).
La separación geográfica del tipo endémico y de la variedad esporádica no es absoluta, puesto que el tipo esporádico puede acontecer en áreas endémicas y viceversa. Los subtipos son histológicamente indistinguibles pero pueden tener diferente epidemiología y diferentes características biológicas. Históricamente la distribución geográfica del LB en África ecuatorial coincide con áreas llanas, cálidas y húmedas con una alta tasa de malaria (11, 15, 21-23).
En África el LB endémico presenta una incidencia de 50-100 casos/millón/año y representa más del 70% de los tumores malignos en niños, siendo entre los 5 y 7 años el pico de máxima incidencia (4, 9, 20, 21). Sin embargo la variante americana no presenta carácter endémico, presentando una incidencia de un caso/millón/año. El pico de máxima incidencia se sitúa entre los 10 y 12 años (4, 20, 21). La obstrucción de las vías respiratorias, intestinales y/o urinarias suele ser más común que en la forma africana (12, 21, 22).
En pacientes inmunodeprimidos se registra una mayor frecuencia de LNH. Más del 95% son de estirpe B y tienen un grado de malignidad alto o intermedio. De los linfomas asociados al S.I.D.A, el LB es el más común, representando el 36% de los casos. Este presenta una rápida progresión clínica, una mayor afectación extranodal y una edad de aparición muy variable. La prevalencia de los linfomas linfocítico y histiocítico en estos pacientes suponen el 34’5 y 8’2% de los casos respectivamente (12, 23). La clínica del LB es muy versátil.
2.1. Manifestaciones sistémicas:
El LB endémico inicialmente suele presentarse como una inflamación de los ganglios linfáticos del cuello y/o de los ganglios inguinales. Estos con frecuencia son indoloros y de crecimiento rápido. En la forma americana, la enfermedad generalmente comienza en el área abdominal, como un dolor en el cuadrante inferior derecho o con obstrucción intestinal aunque también puede iniciarse en otras partes del cuerpo como los ovarios, los testículos o el cerebro (5, 21, 24).
La adenopatía cervical medial ocurre en más del 70% de los casos. Entre las cadenas ganglionares más afectadas se encuentran las cervicales, las supraclaviculares, las mediastínicas, las intraabdominales, las inguinales y las axilares (25). A nivel abdominal los signos más habituales son las masas mediastínicas junto a la hepatomegalia y la ascitis (7, 20). A nivel del sistema nervioso central podemos encontrarnos con cefalea, paraplejía y alteraciones de los pares craneales (21, 26, 27). Otra sintomatología más polimorfa que puede acontecer son la fiebre (concomitante con diaforesis), mareos y/o vómitos, malaabsorción gastrointestinal con la consecuente pérdida de peso, dolor abdominal intenso, astenia, artritis, anemia, cuadros agudos de apendicitis, alteraciones respiratorias y/o tumores ováricos o testiculares (7, 9, 20, 25, 28).
En la literatura se describen casos en los que podemos apreciar una clínica atípica entre la que destaca la anestesia del labio inferior, los abscesos dentarios, la afectación del seno cavernoso o del cordón espermático, el derrame pleural o la afectación del suelo de la boca. Esta clínica tan dispar dificulta la obtención de un diagnóstico precoz y correcto (26, 28-31).
2.2. Manifestaciones bucales:
La tumoración facial, el dolor y la pérdida prematura de los dientes son los signos más precoces y frecuentes entre las manifestaciones bucofaciales. Las lesiones comienzan en el interior del hueso (procesos alveolares), invaden los espacios medulares, crecen rápidamente con una media de 4 semanas y llegan a producir deformación facial generalmente sin ulceración de la piel. Según la localización de estos tumores podemos observar que la tumoración afecta a uno o varios cuadrantes de la boca (30-32) (Figura 1).
Si exploramos los tejidos blandos observaremos petequias en el paladar y una encía engrosada, roja, seca, brillante y dolorosa a la palpación (21, 27, 30-32) (Figura 2). El desplazamiento y la movilidad de los dientes son los signos más comunes entre los tejidos duros, siendo los premolares y los molares los dientes más afectados. La versión vestíbulo-lingual y la extrusión son los desplazamientos dentarios más habituales (9, 30-32).
Si se realiza una exodoncia a un paciente con LB deberemos explorar detenidamente la zona ya que podremos observar un proceso de cicatrización anormal. El alvéolo puede ser ocupado por una zona de tejido de granulación, irregular, de consistencia blanda, ulcerada, de olor fétido, de coloración grisácea junto a zonas de necrosis (30).
Hay que tener presente que las lesiones periapicales tienen una presentación clínica y radiológica similares, por lo que debemos hacer un correcto diagnóstico diferencial (27, 33).
Otros síntomas y signos que podemos encontrar son la imposibilidad para deglutir y/o hablar en casos avanzados donde la extensión del tumor puede superar los varios centímetros de diámetro, dolor a la apertura y cierre de la boca y la anestesia o parestesia del nervio dentario inferior si la tumoración comprime esta estructura.
Los tumores mandibulares han sido confundidos frecuentemente con abscesos de origen dentario, osteomielitis, fibromas osificantes, rabdomiosarcoma embrional, osteosarcoma, quiste dentígero, linfoma no Hodgkin, retinoblastoma, carcinoma de células escamosas, granuloma eosinófilo, ameloblastoma, neuroblastoma y displasia fibrosa, por lo que debemos incluirlos todos en el diagnóstico diferencial (34, 35). El diagnóstico diferencial de los dientes con movilidad en ausencia de factores locales incluye la periodontitis juvenil generalizada, la periodontitis asociada al S.I.D.A, la histiocitosis de células de Langerhans, el síndrome de Papillon-Lefèvre, la hipofosfatasia, la neutropenia cíclica, el raquitismo resistente a la administración de vitamina D, la acrodinia y los linfomas (21, 30, 32).
El LB puede afectar el seno maxilar y/o las fosas nasales. Los linfomas nasosinusales suelen debutar con síntomas inespecíficos como obstrucción nasal, rinorrea o epistaxis. Posteriormente, como consecuencia de la afectación de los órganos vecinos, pueden aparecer cuadros de disminución de la agudeza visual, tumefacción hemifacial, parestesias faciales, etc. En fases avanzadas aparecen síntomas sistémicos como la fiebre, fatiga, dolores óseos o abdominales. Existen pequeñas variaciones clínicas en función del tipo de linfoma. Así tenemos, por ejemplo, que en los LNH de alto grado de malignidad tipo T es más frecuente que exista perforación septal y destrucción nasal, mientras que los de alto grado tipo B, entre los que se incluye el LB, tienen más tendencia a invadir los tejidos vecinos y la órbita (4).
3. ESTUDIOS RADIOLÓGICOS
3.1. Radiología convencional
La radiología convencional, como la ortopantomografía o la radiografía periapical (en el campo de la Odontología), puede revelarnos la existencia de una lesión compatible con LB y de hecho muchas veces es el primer hallazgo que permite llegar a un diagnóstico correcto.
Las características radiológicas de las lesiones en los maxilares compatibles con el tumor revisado no suelen ser muy específicas. Los cambios osteolíticos son los más habituales y siempre requieren un diagnóstico diferencial muy meticuloso entre diferentes entidades como la periodontitis juvenil localizada, las infecciones odontogénicas, la osteomielitis, el hipoparatiroidismo, la hipofosfatasia, la histiocitosis-X o los granulomas eosinófilos, los tumores de los maxilares (ameloblastoma y osteosarcoma), las metástasis secundarias a otras neoplasias, entre un amplio abanico de patologías (9, 21, 36).
Los cambios que se pueden observar en este tipo de radiografías son lesiones osteolíticas alrededor de los dientes, pérdida de las criptas y de la lámina dura, desplazamiento de gérmenes dentarios, ensanchamiento del folículo y la aparición de «dientes flotantes» en lesiones más grandes. En ocasiones puede observarse la reabsorción radicular de los dientes sumergidos o en contacto con la neoplasia. El crecimiento subperióstico del linfoma suele dar una imagen en «rayos de sol», hallazgo que nos obliga a hacer el diagnóstico diferencial con otros tumores de los maxilares. A nivel del maxilar superior se han descrito casos en los que aprecia el borramiento del reborde del seno maxilar. Varios autores coinciden en que estas alteraciones radiológicas pueden ser detectadas antes de que se presente cualquier signo o síntoma clínico (sobre todo en la variante endémica), hecho que permitiría hacer un diagnóstico precoz (9, 27, 32, 36) (Figura 3).
3.2. Tomografía computadorizada y tomografía por emisión de positrones
La tomografía computadorizada (TC) permite hacer exploraciones radiográficas de diferentes zonas anatómicas siendo de gran utilidad para el estudio de la extensión del tumor. En la región bucofacial, permite conocer la extensión tumoral y la relación y posible afectación de estructuras anatómicas de suma importancia como son los grandes vasos sanguíneos y los diferentes espacios anatómicos o otras estructuras cercanas (26).
La tomografía por emisión de positrones (PET) es una técnica de medicina nuclear en la que se utiliza 18F-fluorodesoxiglucosa como trazador radioactivo. Este trazador tiene una alta sensibilidad pero no una especificidad absoluta para los linfomas. Por tanto, al no ser un marcador tumoral específico puede dar falsos positivos. Es interesante utilizar la TC combinada con la PET, ya que de esta forma se obtienen un diagnóstico más preciso al permitir identificar zonas no tumorales marcadas por el trazador (33, 37, 38). La PET permite la valoración del paciente con LB en los diferentes estadios del tratamiento y los resultados negativos de la PET van siempre asociados a evoluciones favorables de la enfermedad por lo que podríamos utilizarla como valor pronóstico (39).
4. OTRAS PRUEBAS COMPLEMENTARIAS
Otras pruebas complementarias que se pueden realizar para el diagnóstico del LB son la analítica sanguínea y la biopsia.
4.1. Analítica sanguínea
Los pacientes con LB pueden presentar una serie de alteraciones no específicas en el hemograma. Entre ellas destacan la anemia (normocítica y normocrómica), la trombocitopenia, las alteraciones de la fórmula leucocitaria y los bajos niveles de los reticulocitos. El hematocrito y la hemoglobina suelen presentar valores ligeramente más bajos en comparación a los valores estándar. Por otro lado, encontraremos aumentados, la velocidad de sedimentación globular (VSG), el ácido úrico, la transaminasa sérica glutámico-oxalacética (SGOT), la enzima fosfatasa alcalina y ciertas inmunoglobulinas. Algunos autores opinan que los niveles de deshidrogenasa láctica (LDH) se encuentran patognomónicamente elevados. Este dato es importante ya que los niveles de LDH están correlacionados con el tamaño del tumor, y por tanto son útiles como valor pronóstico (valores muy elevados son indicativos de un mal pronóstico). Se ha comprobado que cuando se reduce el tamaño del tumor mediante cirugía, los niveles de LDH disminuyen considerablemente. Algunos autores añaden que los niveles de ferritina también pueden ser indicativos del tamaño del tumor (13, 21, 40).
Incluiremos en este apartado los anticuerpos de la malaria y el VEB. Los niveles altos de anticuerpos anti-malaria y de anticuerpos frente el VEB parecen estar relacionados con una mayor incidencia del LB endémico. Se cree que el virus y el parásito actúan de forma sinérgica, ya que se ha comprobado que cuando se encuentran en solitario no se ve aumentada la prevalencia de la enfermedad. Otros estudios refieren que el 95% de los pacientes con LB endémico presentan infección por el VEB y que existe una estrecha relación entre VEB y el LB. El mecanismo de actuación no está claro, existiendo diversas hipótesis. La más extendida apoya que el paludismo o la malaria (siendo el parásito Plasmodium falciparum causante de la enfermedad) conduciría a la reactivación de los linfocitos B, los cuales podrían ser infectados por el VEB suprimiendo las células T específicas anti-VEB. Hay estudios que remarcan que no hay que atribuir este hecho a la malaria sino a otros factores como parásitos intestinales que coexisten en zonas de distribución del paludismo (11, 13, 22, 40-42).
4.2. Biopsia y estudio anatomopatológico
La biopsia incisional es la prueba diagnóstica que nos dará el diagnóstico de certeza y por tanto es la prueba complementaria más importante. Cuando incluyamos en el diagnóstico diferencial el LB deberemos informar al patólogo para que no confunda la neoplasia con un trastorno linfoproliferativo benigno (1, 2, 30).
Anatomopatológicamente la biopsia excisional ganglionar muestra una proliferación difusa de células medianas no hendidas, entre las cuales pueden intercalarse histiocitos con restos celulares en su interior (grasa y restos nucleares desintegrados o degenerados) lo que produce áreas claras en un contenido de linfocitos, dando una imagen descrita como en «cielo estrellado» (9, 21, 34, 40).
Con una muestra del tejido extirpado se debe hacer un estudio inmunohistoquímico, imprescindible hoy en día para el diagnóstico de certeza del LB. La inmunohistoquímica consiste en la aplicación de un anticuerpo dirigido específicamente contra el antígeno que queramos demostrar y un sistema de visualización que permita detectar si ha habido fijación del anticuerpo al tejido. Los antígenos específicos de las células de la línea B son CD20, CD19, CD79a y CD10 y por lo tanto serán positivos en el estudio inmunohistoquímico del LB. Otros antígenos como Bcl-2 (proteína inducida por oncógenes) y TdT (deoxirribonucleotidil transferasa terminal) deberán ser negativos para la muestra de la biopsia y el antígeno Ki-67 (proteína relacionada con la proliferación) será positivo para cualquier tumor (24, 27, 43-45). En los países en vías de desarrollo, el estudio inmunohistoquímico se reserva a los casos complejos, siendo la tinción con hematoxilina-eosina la prueba complementaria por excelencia por su menor coste económico. Hay varios estudios que han valorado la sensibilidad y la especificad de la tinción para el diagnóstico del LB obteniendo unos resultados del 76,6 al 93,2% y de 50 al 92,7% respectivamente (34, 44, 46, 47).
El análisis genético se reserva para los casos más complejos en los que el diagnóstico es muy difícil. El LB en la mayoría de los casos presenta una translocación del cromosoma 8 al 14 (q24;q32) que afecta al protooncogen c-myc. Esta translocación es capaz de inducir la proliferación rápida de células malignas tipo B. En las biopsias de LB se detectan niveles elevados de expresión de este gen, hecho que permite utilizar la técnica para el diagnóstico del linfoma. Sin embargo estudios recientes mencionan si este gen también se expresa en otros linfomas de células B y que por tanto no presenta tanta especificidad como se le había atribuido (22, 27, 35, 48-50).
5. PRONÓSTICO
En general presenta una evolución aguda o subaguda. La afectación del estado general se establece en un periodo corto, presentándose fiebre, astenia, dolor abdominal y cuadros obstructivos intestinales. En la mitad de los casos la primera manifestación clínica es una inflamación en el maxilar (superior y/o inferior) que se confunde con un absceso que no remite con antibióticos (22).
El pronóstico depende de la extensión de la enfermedad, de la edad del paciente y del momento del diagnóstico. Es excelente en los niños, donde la tasa de supervivencia alcanza casi el 100% de los casos, y la ausencia de morbilidad se sitúa entre el 75 y 85% de los casos. Los adultos no son tan afortunados, ya que su tasa de supervivencia se sitúa entre el 50 y el 75%, debido a que la mayoría de estos pacientes están afectados por el S.I.D.A (30, 52). La tasa de supervivencia puede ser más baja si la neoplasia se extiende a la médula ósea u a otros órganos, siendo más favorable cuando se diagnostica en etapas tempranas (30, 52). Los pacientes que tienen el tumor localizado exclusivamente en la región de cabeza y cuello presentan una tasa de supervivencia mayor (53).
En estadios iniciales el LB endémico presenta mejor pronóstico que el LB esporádico, mientras que en casos avanzados es el LB esporádico el que evidencia mayores índices de supervivencia (4, 10). Más de la mitad de los pacientes con LB se pueden curar con quimioterapia intensiva, aunque sin el tratamiento adecuado el tiempo de supervivencia es inferior a 6 meses (2, 53, 54).
6. TRATAMIENTO
El LB tiene una rápida progresión, lo que hace muy urgente su tratamiento. Siempre debe efectuarse una cuidada historia clínica, un examen físico completo junto al estudio de la función renal; realizando tomografías y ultrasonografía abdominal para observar la localización del tumor y vigilar la respuesta al tratamiento (2, 55).
El tratamiento de elección es la quimioterapia intensiva y de corta duración, con la que el 80 al 90% de los niños y adolescentes se pueden curar. El tratamiento se debe iniciar rápidamente, debido a la rápida progresión tumoral, para evitar problemas obstructivos intestinales o hemorrágicos. La cirugía y la radioterapia quedan en un segundo plano. La cirugía debe utilizarse como método diagnóstico y no para practicar grandes resecciones tumorales.
La quimioterapia consiste en la administración de dosis intensivas de ciclofosfamida (que puede alternarse con ifosfamida) en combinación con otros agentes activos (especialmente metotrexato, vincristina, antraciclínicos y citarabina), durante 4 meses. Los excelentes resultados obtenidos utilizando los ciclos de quimioterapia hacen que no esté indicado el transplante autólogo de células progenitoras hematopoyéticas en la primera remisión completa. Los pacientes antes considerados de mal pronóstico (edad inferior a los 15 años, LDH elevada o compromiso de la médula ósea o el sistema nervioso central) han incrementado su tasa de supervivencia al 70-80% a los 4 años. Las recidivas suelen ocurrir antes de los 6 meses y su tasa de supervivencia es del 10-20% a los 5 años. La terapia antirretroviral también es utilizada en el tratamiento de estos pacientes, sobre todo los que presentan estados de inmunodeficiencia asociados (18, 51, 56, 57) (Figura 4).
Los pacientes sensibles a la quimioterapia de rescate deben tratarse con altas dosis de quimioterapia ablativa y con trasplante autólogo de células hematopoyéticas, con lo que se logra una supervivencia libre de enfermedad superior al 50%. Los pacientes primariamente refractarios al tratamiento o que presentan recidivas no quimiosensibles tienen mal pronóstico y en ellos el autotransplante tampoco es eficaz (24, 40).
Los pacientes con LB endémico que viven en África ecuatorial tienen pocas posibilidades de acceder a tratamientos modernos. Un estudio reciente mostró que el empleo de uno o más ciclos con sólo ciclofosfamida logró el 63% de tasa de supervivencia en niños cuya enfermedad estaba limitada a la cabeza y del 33% cuando además se afectaban otras localizaciones (31, 40, 58).
Cabe destacar, que en los casos donde la respuesta al tratamiento es adecuada las manifestaciones bucales desaparecen. El tratamiento bucodental se enfoca a controlar de forma paliativa los efectos secundarios de la quimioterapia, siendo la mucositis la más representativa (59).
CONCLUSIONES
El papel del odontólogo ante el diagnóstico precoz del LB es muy importante, ya que la tasa de supervivencia aumenta de forma significativa en los pacientes donde el diagnóstico se efectúa de forma precoz.
Los dentistas deben sospechar esta patología cuando se enfrentan con un paciente pediátrico con hipermovilidad dentaria, supra-erupción de los dientes permanentes y con una reabsorción del hueso alveolar grave alrededor de estos, en los que no exista una etiología que justifique la clínica. La parestesia inexplicable del nervio dentario inferior debe ser también inquietante. Cuando alguno de estos síntomas o signos se presenta, el odontólogo debe tener un alto índice de sospecha y actuar con prontitud.
El tratamiento de éstos pacientes de forma inadecuada puede conducir rápidamente a consecuencias desastrosas como el fallecimiento del paciente, mientras que si hacemos un diagnóstico y tratamiento precoces el índice de supervivencia es muy alto. Por este motivo, es importante aprender a identificar cualquier patología con repercusión bucal ya que de nosotros depende hacer un diagnóstico precoz correcto, y por tanto aumentar la tasa de supervivencia de los pacientes con esta enfermedad.
AGRADECIMIENTOS
Este estudio ha sido realizado por el grupo de investigación consolidado «Patología y Terapéutica Odontológica y Maxilofacial» del Institut d’Investigació Biomèdica de Bellvitge (IDIBELL) con el soporte económico del convenio docente-asistencial de Cirugía Bucal entre la Universidad de Barcelona, el Consorci Sanitari Integral y el Servei Català de la Salut de la Generalitat de Catalunya.



BIBLIOGRAFÍA
- Ceballos H, Martagón LR. Linfoma de Burkitt con repercusión estomatológica. Informe de un caso. Acta Pediatr Mex. 2005;26:67-70.
- Cruz O, San Román M, Villaronga M. Burkitt’s lymphoma in Africa. Management and treatment. Acta Pediatr Mex. 2005;24:35-7.
- Hasserjian R, Ott G, Elenitoba-Johnson K, Balague-Ponz O, de Jong D, de Leval L. Commentary of the WHO Classification of tumors of lymphoid tissues (2008): «Gray zone» lymphomas overlapping with Burkitt lymphoma or classical Hodgkin lymphoma. J Hematopathol. 2009;2:89-95.
- García FJ, Morant A, Tormos MM, Algarra JM. Disfagia alta por linfoma de Burkitt de amígdala lingual resistente a quimioterapia. Acta Otorrinolaringol Esp. 2003;54:109-12.
- Pereira CM, Lopes AP, Meneghini AJ, Silva GB, Monteiro MC, Botelho T. Burkitt’s lymphoma in a young Brazilian boy. Malays J Pathol. 2010;32:59-64.
- Coakley D. Denis Burkitt and his contribution to haematology/oncology. Br J Haematol. 2006;135.17-25.
- Cruz O, San Román M, Villaronga M. Burkitt’s lymphoma in Africa. Acta Pediatr Mex. 2005;26:70-72.
- Balasubramaniam R, Goradia A, Turner LN, Stoopler ET, Alawi F, Frank DM et al. Burkitt lymphoma of the oral cavity: An atypical presentation. Oral Surg Oral Med Oral Pathol Oral radiol Endod. 2009;107:240-5.
- Gay-Escoda C, Lu-Cortés L, Rodríguez J, Girons S, Guiu M. Linfoma de Burkitt: A propósito de dos casos. Rev Esp Cir Oral Maxilofac. 1982;9:19-28.
- Koffi GK, Tolo A, Nanho DC, N’Dathz E, Kouassi MY, N’Diaye FD et al. Results of treatment with CMA, a low intermediate regimen, in endemic Burkitt lymphomas in sub-Saharian Africa: Experience of Cote d’Ivoire. Int J Hematol. 2010; 91:838-43.
- Ogwang MD, Bathia K, Biggar RJ, Mbulaiteye Sm. Incidence and geographic distribution of endemic Burkitt lymphoma in northern Uganda revisited. Int J Cancer. 2008;123:2658-63.
- Kalungi S, Wabinga H, Molven A, Bostad L. Lymphomas diagnosed in Uganda during the HIV/AIDS pandemic. East Afr Med J. 2009;86:226-32.
- Carpenter LM, Newton R, Casabonne D, Ziegler J, Mbulaiteye S, Mbidde E et al.. Antibodies against malaria and Epstein-Barr virus in childhood Burkitt lymphoma: A case-control study in Uganda. Int J Cancer. 2008;122:1319-23.
- Queiroga EM, Gualco G, Chioato L, Harrington WJ, Araujo I, Weiss LM et al. Viral studies in Burkitt’s lymphoma: Association with Epstein-Barr virus but not HHV-8. Am J Clin Pathol. 2008;130:186-92.
- Tumwine LK, Orem J, Kerchan P, Byarugaba W, Pileri SA. EBV, HHV8 and HIV in B cell non Hodgkin lymphoma in kampala, Uganda. Infect Agent Cancer. 2010;5:12-9.
- Cader FZ, Kearns P, Young L, Murray P, Vockerodt M. The contribution of the Epstein-Barr virus to the pathogenesis of childhood lymphomas. Cancer Treat Rev. 2010;36:348-53.
- Chene A, Donati D, Orem J, Mbidde ER, Kironde F, Wahlgren M et al. Endemic Burkitt’s lymphoma as a polimicrobial disease: New insights on the interaction between Plasmodium falciparum and Epstein-Barr virus. Semin Cancer Biol. 2009;19:411-20.
- Kelemen K, Braziel RM, Gatter K, Bakke TC, Olson S, Fan G. Inmunophenotypic variations of Burkitt lymphoma. Am J Clin Pathol. 2010;134:127-38.
- Seegmeller AC, García R, Huang R, Maleki A, Karandikar NJ, Chen W. Simple Karyotype and bcl-6 expression predict a diagnosis of Burkitt lymphoma and better survival in IG-MYC rearranged high-grade B-cell lymphomas. Mod Pathol. 2010;23:909-20.
- Mwanda OW. Clinical characteristics of Burkitt’s lymphoma seen in Kenyan patients. East Afr Med J. 2004;8:78-89.
- Svoboda WE, Aaron GR, Albano EA. North American Burkitt’s lymphoma presenting with intraoral symptoms. Pediatric Dentistry 1991;13:52-8.
- Orem J, Mbidde EK, Lambert B, de Sanjose S, Weiderpass E. Burkitt’s lymphoma in Africa, a review of the epidemiology and etiology. Afr Health Sci. 2007;7:166-75.
- Mwakigonja AR, Kaaya EE, Mgaya EM. Malignant lymphoma’s (ML) and HIV infection in Tanzania. J Exp Cancer Res. 2008;10:27-9.
- Mwanda OW, Rochford R, Moormann AM, Macneil A, Whalen C, Wilson ML. Burkitt’s lymphoma in Kenya: Geographical, age, gender and ethnic distribution. East Afr Med J. 2004;8:68-77.
- Comfort AO. Burkitt’s lymphoma of the jaws: Role of dental practitioner in management. Pac Health Dialog. 2004;11:89-93.
- Ugar DA, Bozkaya S, Karaca I, Tokman B, Pinarli FG. Childhood craniofacial Burkitt’s lymphoma presenting as maxillary swelling: Report of a case and review of literature. J Dent Child (Chic). 2006;73:45-50.
- Tsui SH, Wong MH, Lam WY. Burkitt’s lymphoma presenting as mandibular swelling, report of a case and review of publications.Br J Oral Maxillofac Surg. 2000;38:8-11.
- Landesberg R, Yee H, Datikashvili M, Ahmed AN. Unilateral mandibular lip anesthesia as the sole presenting symptom of Burkitt’s lymphoma: Case report and review of literature. J Oral Maxillofac Surg. 2001;59:322-6.
- Zhou Q, Leng DN, Zhang ZX, Zhou HB, Shi OL, Zhou XJ. Burkitt’s lymphoma of the spermatic cord: A case report and review of the literature. Zhonghua Nan Ke Xue. 2008;14:624-7.
- Rasper M, Kesari S. Burkitt’s lymphoma presenting as a rapidly evolving cavernous sinus syndrome. Arch Neurol. 2008;65:1668.
- Freitas R, Barros S, Quindere L. Oral Burkitt’s lymphoma: Case report. Rev Bras Otorrinolaringol. 2008; 74: 458-61.
- Liu RS, Liu HC, Bu JQ, Dong SN. Burkitt’s lymphoma presenting with jaw lesions. J Periodontol. 2000;71:646-9
- Kazama T, Faria SC, Varavithya V, Phongkitkarun S, Ito H, Macapinlac HA. FDG PET in the evaluation of treatment for lymphoma: Clinical usefulness and pitfalls. Radiographics. 2005;25:191-207.
- Tumwine LK, Wabinga H, Odida M. Haematoxylin and eosin staining in the diagnosis of Hodgkin’s disease in Uganda. East Afr Med J. 2003;80:119-23.
- Dave SS, Fu K, Wright GW, Lam LT, Kluin P, Boerma EJ et al. Molecular diagnosis of Burkitt’s lymphoma. N Engl J Med. 2006;354:2431-42
- Nortjé CJ. General practitioner’s radiology case 63. Burkitt’s lymphoma. SADJ. 2008;63:248-50.
- Castellucci P, Zinzani P, Pourdehnad M, Alinari L, Nanni C, Farsad M et al. 18F-FDG PET in malignant lymphoma: Significance of positive findings. Eur J Nucl Med Mol Imaging. 2005;32:749-56.
- Castellucci P, Nanni C, Farsad M, Alinari L, Zinzani P, Stefoni V et al. Potential pitfalls of 18F-FDG PET in a large series of patients treated for malignant lymphoma: Prevalence and scan interpretation. Nucl Med Commun. 2005;26:689-94.
- Just PA, Fieschi C, Baillet G, Galicier L, Oksenhendler E, Moretti JL. 18F-fluorodeoxyglucose positron emission tomography/computed tomography in AIDS-related Burkitt’s lymphoma. AIDS Patient Care STDS. 2008;22:695-700.
- Ferreras R. Tratado de medicina interna. 15 ed. Madrid: Elsevier; 2004.
- Njie R, Bell AI, Jia H, Croom-Carter D, Chaganti S, Hislop AD. The effects of acute Malaria on Ebstein-Barr virus (EBV) load and EBV-especific T cell Immunity in Gambian Children. J Infect Dis. 2009;199:31-8.
- Watanabe A, Maruo S, Ito T, Ito M, Katsumura KR, Takada K. Epstein-Barr virus-encoded Bcl-2 homologue functions as a survival factor in Wp-restricted Burkitt lymphoma cell line P3HR-1. J Virol. 2010; 84:2893-901.
- Ordi J. Anatomía patológica general. Barcelona: Editorial Universidad de Barcelona; 2006.
- Lukande R, Wabinga HR, Tumwine LK. Burkitt’s lymphoma in Uganda: The role of immunohistochemistry in diagnosis. East Afr Med J. 2008;85:207-12.
- Mesquita RA, de Araújo VC, Paes RA, Nunes FD, de Souza SC. Immunohistochemical analysis for CD21, CD35, Caldesmon and S100 protein on dendritic cells types in oral lymphomas. J Appl Oral Sci. 2009;17:248-53.
- Tumwine LK. Immunohistochemical analysis of Hodgkin’s disease in Kampala, Uganda. East Afr Med J. 2004;81:34-7.
- Pazoki A, Jansisyanont P, Ord RA. Primary non-Hodgkin’s lymphoma of the jaws: Report of 4 cases and review o the literature. J Oral Maxillofac Surg. 2003;61:112-7
- Manolopoulos L, Nikolopoulos TP, Yiotakis J, Karapatsas J, Maris A, Ferekdis E. Burkitt’s lymphoma in the base of the tongue: Differential diagnosis and management. ORL. 2003;65:226-9
- Gupta H, Davidoff AM, Pui CH, Schochat SJ, Sandlund JT. Clinical implications and surgical management of intussusception in pediatric patients with Burkitt lymphoma. J Pediatric Surg. 2007,42:998-1001
- De Larrinoa AF, del Cura J, Zabala R, Fuertes E, Bilbao F, Lopez JI. Value of ultrasound-guided core biopsy in the diagnosis of malignant lymphoma. J Clin Ultrasound. 2007;35:295-301
- Tang W, Harmon P, Gulley ML, Mwansambo C, Kazembe PN, Martinosn F et al. Viral response to chemotherapy in endemic Burkitt lymphoma. Clin Cancer Res. 2010;16: 2055-64.
- Yustein JT, Dang CV. Biology and treatment of Burkitt’s lymphoma. Curr Opin Hematol. 2007;14:375-81.
- Kazembe P, Hesseling PB, Griffin BE, Lampert I, Wessels G. Long term survival of children with Burkitt lymphoma in Malawi after cyclophosphamide monotherapy. Med Pediatr Oncol. 2003;40:23-5.
- Jan A, Vora K, Sándor GK. Sporadic Burkitt’s lymphoma of the jaws: The essentials of prompt life-saving feral and management. J Can Dent Assoc. 2005;71:165-8.
- Kenkre VP, Stock W. Burkitt lymphoma/leukemia: Improving prognosis. Clin Lymphoma Myeloma. 2009;9:231-8
- Mantina H, Wiggill TM, Carmona S, Perner Y, Stevens WS. Characterization of lymphomas in a high prevalence HIV setting. J Acquir Immune Defic Syndr. 2010;53:656-60.
- Tumwine LK, Agostinelli C, Campidelli C, Othieno E, Wabinga H, Righi S et al. Inmunohistochemical and other prognostic factors in B cell non Hodgkin lymphoma patients, Kampala. BMC Clin Pathol. 2009;16:9-11.
- Aldoss IT, Weisenburger DD, Fu K, Chan WC, Vose JM, Bierman PJ. Adult Burkitt lymphoma: Advances in diagnosis and treatment. Oncology. 2008;22:1508-17.
- Hoelzer D. Update on Burkitt lymphoma and leukemia. Clin Adv Hematol Oncol. 2009;7:728-9.
Análisis microscópico de la superficie de tres tipos de resina acrílica utilizada para base de dentaduras removibles
MICROSCOPIC ANALYSIS OF SURFACE OF THREE TYPES OF ACRYLIC RESINS FOR DENTURE REMOVIBLES BASE.
Gladys Velazco1, Reynaldo Ortiz2, Lorena Bustillos1, Leylan Arellano1
1Facultad de Odontología. Laboratorio Integrado de Biología Celular y Molecular (LIBCEM).
2. Facultad de Ciencias. Laboratorio de Electroquímica. Universidad de Los Andes. Mérida-Venezuela.
Autor para correspondencia
E-mail: gvelazco@ula.ve
Dirección postal:
Resumen
El polimetacrilato de metilo es el polímero acrílico más versátil en aplicaciones médicas y odontológicas, siendo el de elección en la elaboración de bases para las dentaduras removibles y cuyos procesos de polimerización producen diferencias estructurales en cada uno de ellos. La permanencia en boca de estos aparatos produce cambios tisulares en los tejidos de soporte, los cuales son susceptibles a lesiones como la estomatitis subprotésica promovida por microorganismos como la C. Albicans que por su naturaleza se adhiere y crece en superficies y con mayor énfasis en las que presentan asperezas. El propósito del estudio fue analizar tres tipos de resinas acrílicas con Microscopía Electrónica superficies utilizadas para preparar bases de dentaduras removibles. Se observaron grietas de diferentes tamaños y múltiples irregularidades, agujeros y porosidades dependiendo del tipo de polimerización, y en un caso disolución parcial de la superficie del material.
Palabras clave: Resinas acrílicas, Estomatitis, Edentulismo
Abstract
Polymethyl methacrylate is the more versatile acrylic polymer in medical and dental applications, being one of election in making bases for removible dentures, and whose polimerization processes produces structural differences in each one of them. The permanency of dentures in mouth produces changes in the supporting tissues, which are susceptible to lesions like prosthethics stomatitis promoted by microorganisms as C. Albicans that by nature adheres and grows in surfaces with greater emphasis in those with roughness. The intention of this study was to analyze with Electronic Microscopy surfaces of acrylic resins used to make denture bases. Cracks of different sizes were observed, irregularities, holes and porosities depending on polimerization processes as well as a partial dissolution case of the surface of the material.
Key words: Acrylic resins, denture stomatitis, edentulous
INTRODUCCION:
El polimetacrilato de metilo es el polímero acrílico más conocido por su versatilidad en aplicaciones médicas y odontológicas1. Las bases de las dentaduras removibles están fabricadas de resina acrílica a base de polimetilmetacrilato (PMMA), que en forma de una superficie sólida se encuentra en contacto con la mucosa bucal del paciente; la polimerización del PMMA por calor y microondas son las técnicas más comúnmente utilizadas para realizarlas, y los acrílicos de polimerización química para fabricar cubetas individuales o en todo caso bases de aparatos muy temporales y/o provisionales2.El contacto constante de las dentaduras removibles en la mucosa se soporte produce cambios tisulares locales, que posteriormente se traducen en un proceso de adaptación, del cual dependerá el éxito o no del tratamiento; pero pueden originar diferentes lesiones como la Estomatitis Subprotésica (ES). Al analizar las lesiones de común aparición en los tejidos de la mucosa bucal en pacientes sometidos a tratamiento protésico, incluyen estomatitis, herpes, eritema migratorio, liquen plano y candidiasis, describen la característica clínica relevante de la candidiasis oral generalmente acompañada de pseudomenbranas, glositis y queilitis angular, concluyen que es una patología común en infantes y adultos relacionándose con inmunodeficiencias (problemas de tipo inmunológico)3, 4. La micosis producida por Candida albicans, es una de las principales causas de estomatitis subprotesica, debido a que la presencia de estos hongos generalmente sugiere un estado de inmunodeficiencia primaria o secundaria que altera los mecanismos de defensa, facilita la proliferación bacteriana alterando la microflora normal de la cavidad bucal5. La adhesión de C. albicans a los materiales dentales restauradores puede promover la ocurrencia de candidiasis oral. Al verificar la relación entre la presencia de la ES y la frecuencia de colonias de C. Albicans en portadores de la dentadura, una relación directa fue observada entre la presencia de la C. Albicans y el uso nocturno de la dentadura (P =.01)6. La relación de la ES con la presencia de hifas y lactobacilos de Candida Albicans, demuestra que la asociación estadístico significativa con el tiempo de uso de la dentadura (p = 0.003) y el uso continuo de la dentadura (p = 0.015), la presencia de hyphae de C. Albicans fue significativamente alta en los casos de ES (p< 0.01), con correlación estadística significantemente positiva entre la presencia de hyphae y lactobasilos de C. Albicans (p < 0.01)7. Los mecanismos y la significación clínica de la adherencia de la C. Albicans a los materiales de las bases para dentadura y su relación con la ES, no la relacionan de un todo con la aspereza superficial pero esta condición puede afectar la retención de microorganismos8. La superficie de las resinas puede ser colonizada por microorganismos pues el crecimiento en superficies es natural en la forma de vida de la C. Albicans9. Si la superficie presenta defectos (poros, grietas e irregularidades) producidas al momento de su elaboración independientemente del método del procesado, pueden ser excelentes reservorios para hongos y bacterias oportunistas, en especial de la C. Albicans. Al evaluar la influencia de la saliva humana y de dos métodos de polimerización (Termocurado, microonda) en la adherencia de cuatro especies de Candida a las superficies del acrílico, encontraron que la saliva es capaz de reducir la adherencia de la especie del Candida a las superficies acrílicas, no reportaron diferencias estadísticas con respecto a la aspereza de las superficies9. Similares hallazgos determinaron la influencia de la aspereza superficial de la superficie libre de energía de la saliva, y la adherencia de bacterias y Candida a los materiales de la dentadura, la colonización por bacterias fue disminuida perceptiblemente por la saliva, así como la adherencia del Candida10. Al estudiarse las características de los biofilms duales de especies de Candida albicans y la krusei sobre superficies de acrílico de dentaduras, ya que un 15% de la patogénesis bucal puede ser debido a la especie dual del Candida, los datos sugieren que las interacciones competitivas de especies de hongos son probablemente importantes en la formación del biofilm en superficies de acrílico y que la saliva humana puede influir en este proceso11. Por otra parte la colonización y adherencia a corto plazo de la C. albicans en seis materiales para el remarginado de dentaduras, y supervisar cualquier penetración a más largo plazo de estos materiales por parte de la levadura, lo que puede ocasionar su deterioro y subsecuentes problemas clínicos, reportan que las superficies más lisas guardaron pocas células del microorganismo pero en las superficies ásperas el número fue visiblemente más alto (p< 0.001)12. La adherencia de C. Albicans en la aspereza superficial de diferentes acabados de resinas de acrílico para base de dentadura y de resinas resilientes de silicón para rebase de dentaduras, se reporta que en todos los tipos de acabados finales superficiales, la adherencia de C. Albicans en los acrílicos de base de dentadura era visiblemente menos (media 90.18-90.40) que en los de rebasados resilientes de silicón (media 119.38-205.18 ; p m < 0.01, Kruskal-Wallis)13.La presencia de C. Albicans ha sido claramente demostrada tanto en bases protésicas como en materiales acondicionadores usando Microscopia Electrónica de Barrido (MEB)14,15. Existe clara evidencia que la aspereza superficial de todas las resinas aumenta con el uso, lo que pudiera ocasionar susceptibilidad a la colonización microbiana subsecuente16. Existen estudios donde modificaron las características superficiales del PMMA, preparando tres grupos, un control y dos modificados, luego de 12 días de incubación de C. Albicans, encontraron diferentes niveles de adhesión sobre las superficies de las resinas, afirman que la modificación de las características superficiales de biomateriales poliméricos es un método eficaz en la reducción de la adherencia de la C. Albicans a las superficies de PMMA17. Tambien la adición de carga aniónica en las resinas para base de dentadura ha demostrado ser un inhibidor en la adherencia de C. Albicans y facilita la absorción de las moléculas salivales de defensa18.
El propósito del presente estudio fue analizar con Microscopía Electrónica (MEB) dos superficies de resinas acrílicas utilizadas para preparar bases de dentaduras removibles, una superficie de resina autopolimerizable utilizada para bases de dentaduras provisionales y una superficie acrílica de una dentadura utilizada por un paciente con ES diagnosticada, y comparar los resultados de las cuatro microfotografías
MUESTRAS:
Para este estudio se realizaron 30 muestras de 1cm de alto por 1cm de ancho, elaboradas con tres acrílicos de diferente polimerización. Divididas en tres grupos de 10, un grupo fue sometido a termo polimerización, el segundo a microondas y el tercero por curado químico todos, siguiendo las indicaciones de manufactura proporcionadas por el fabricante. Las muestras fueron llevadas al Laboratorio de Análisis Químico y Estructural de Materiales (LAQUEM), Departamento de Física, Facultad de Ciencias de la Universidad de Los Andes para ser analizadas, se cubrieron con una capa de oro por aproximadamente 15 min, metalizado indispensable, porque además de hacer conductiva la superficie, elimina la electricidad estática, minimiza el daño por radiación y aumenta la reflectividad electrónica siendo montadas y observadas en un microscopio electrónico de barrido HITACHI® modelo S-2500. Por otra parte se escogió un paciente de la Clínica Integral del Adulto III portador de dentaduras totales y diagnosticado con Estomatitis Subprotésica (ES), quien previo consentimiento y posterior a la elaboración de la historia clínica, se le tomaron las fotografías clínicas y retiro de las dentaduras para observación microscópica bajo la misma técnica.
RESULTADOS:
En la figura 1.a presenta una resina acrílica termo polimerizado a 100 X, la superficie es homogénea, evidenciándose grietas dispuestas paralela y perpendicularmente unas sobre otras. La figura 1.b resina acrílica de microondas con una superficie bastante irregular múltiples cúmulos con defectos superficiales y profundos. La figura 1.c representa la superficie de un resina acrílica de auto polimerización, con un área no homogénea, con cúmulos, grietas y disolución de algunas áreas indicadas. A esta magnificación las superficies presentadas difieren en homogeneidad, número y profundidad de defectos. A una magnificación de 500X, en la figura 2.a la resina de termo polimerización evidencia la presencia de grietas horizontales y paralelas entre sí en mayor número y profundidad que las perpendiculares, la figura 2.b superficie de la resina polimerizada por microondas un defecto con descamaciones en la periferia que se pronuncian al fondo del defecto con una profundidad considerable. En la 2.c la resina de autocurado presenta cúmulos en forma circular asociados en su mayoría a grietas presentes en el material. Magnificando a 2000X la figura 3.a las grietas en las resinas de termo polimerización con mayor profundidad y amplitud, en la 3.b se observa la diferencia entre un defecto y la superficie homogénea en una resina de curado por microondas, con una descamación evidente del material, en la 3.c la resina de autocurado los cúmulos depositados en las grietas presentes en la superficie. La figura 3.d representa una base de prótesis retirada a un paciente diagnosticado con ES, observándose una completa desorganización en la superficie del material, cúmulos y grietas dispersas en la superficie delimitadas por zonas de menor electrodensidad con fondos de mayor electrodensidad lo que representa disolución parcial de la superficie del material.
DISCUSION:
El método de polimerización es altamente influyente en la calidad final de la superficie acrílica. El termocurado proporciona una superficie con menos defectos y poros, comparativamente con las superficies de microondas y autocurado, Por naturaleza la C. Albicans se adhiere y crece en las superficies, la adhesión de la C. Albicans a las superficies de las bases protésicas ha sido ampliamente reportado 6,9,10,12,13,14,15,16,17,18, relacionando así mismo el microorganismo con la presencia de ES5,6,7. Se ha relacionado el número de C. Albicans con el uso nocturno, tiempo de uso y el uso continuo de las dentaduras7, también con superficies ásperas o porosas9, 12,16 lo que relaciona la adhesión directamente con las porosidades y defectos presentes en la estructura. Un hallazgo importante es que la saliva puede inhibir la adherencia de C. Albicans en las superficies de las bases acrílicas10. Los cambios estructurales que puede sufrir el material por la acción de factores como el uso constante, la adherencia de microorganismos y los defectos de estructura ocasionados por las técnicas de polimerización, deben ser considerados y evaluados atentamente por el odontólogo cuando rehabilita con dentaduras removibles. El mantenimiento de la salud bucal de los pacientes es fundamental y es necesario prevenir las situaciones anómalas provocadas por los mismos tratamientos.
CONCLUSIONES: Las resinas acrílicas en cualquiera de sus formas siguen siendo los materiales de elección para la elaboración de las bases de las dentaduras removibles. Debe tomarse especial atención a los sistemas de polimerización de estos materiales, realizando apropiadamente los protocolos recomendados por las casas fabricantes para las diversas técnicas de polimerización, ya que estos aparatos permanecen en el medio bucal y procesos de curado deficientes ocasionan gran cantidad de defectos estructurales del material que permiten la adherencia de microorganismos como la C. Albicans que favorecen la aparición de lesiones como la ESP.
AGRADECIMIENTOS:
Este trabajo fue posible gracias al apoyo otorgado por el CDCHT-ULA a través del proyecto O-223-08-07-B y al Laboratorio de Análisis Químico y Estructural de Materiales (LAQUEM), Departamento de Física, Facultad de Ciencias, ULA.
BIBLIOGRAFIA
•1. Sastre R., De Aza S., San Román J. Biomateriales para la salud. Primera Edición. Editorial Programa Iberoamericano CYTED. 2006. Pag: 89-99.
•2. Anusavice K., Phillips J. Ciencia de los materiales dentales. 11ª Editorial Elsevier España, 2004.Pag: 56-9.
•3. Mata de Henning M., Perrone M. La prótesis odontológica en la ecología de candida albicans en cavidad bucal. Acta Odontol Venez. 2001, 39, 70-7
•4. Gonsalves W., Chi A., Neville B. Common oral lesions: Part I. Superficial mucosal lesions. Am Fam Physician. 2007, 15, 68-77.
•5. Lazarde, L., Añez, O. Candidiasis multifocal bucal. Acta odontol Venez. 2003, 4, 31-34.
•6. Bürgers R, Schneider-Brachert W, Rosentritt M, Handel G, Hahnel S. Candida albicans adhesión to composite resisn materials. Clin Oral Investig. 2008, 13, 293-299,
•7. Bilhan H., Sulun T., Erkose G., Kurt H., Erturan Z., Kutay O., Bilgin T. The role of candida albicans hyphae and lactobacillus in dentare-related stomatitis. Clin Oral Investig, 2008;12, 51-58.
•8. Radford D., Challacombe S., Walter J. Denture plaque and adherence of Candida albicans to denture-base materials in vivo and in Vitro. Crit Rev Oral Biol Med, 2009,10, 99-116.
•9. Moura J., da Silva W., Pereira T., Del Bel Cury A., Rodrigues Garcia R. Influence of acrylic resin polymerization methods and saliva on the adherence of four Candida species. J Prosthet Dent, 2006, 3, 205-11.
•10. Pereira-Cenci T., Cury A., Cenci M., Rodrigues-Garcia R. In Vitro candia colonization on acrylic resins and dentare liners: influence of surface free energy, rougness, saliva, and adhering bacteria. Int J Prosthodontic, 2007; 3, 308-10.
•11. Thein Z., Samaranayake Y., Samaranayake L. Characteristics of dual species candida biofilms on dentare acrylic surfaces. Arch Oral Biol, 2007, 12, 1200-8.
•12. Bulad K., Taylor L., Verran J., McCord J. Colonization and penetration of denture soft lining materials by Candida albicans. Dent Mater, 2004, 2, 167-75.
•13. Nevzatoglu E., Ozcan M., Kulak-Ozkan Y., Kadir T. Adherence of candida albicans to dentare base acrylics and silicone-based resilient liner materials with different surface finishes. Clin Oral Investig, 2007; 3, 231-6.
•14. Arellano L, Velazco G, Ortiz R, Bustillos L. Evidencia microscópica de candida albicans en una resina resiliente para rebase de dentaduras. ODOUS, 2009; 1, 17-20.
•15. Velazco G., Ortiz R., Arellano L., Bustillo L., Gonzalez A. Evidencia microscópica de la presencia de Candida albicans en bases protésicas retiradas de la cavidad bucal. Revista Cubana de Estomatología. 2009; 2, 2-8.
•16. Taylor L., Bulad K., Verran J., McCord F., Colonization and deterioration of soft dentare lining materials in vivo. Eur J Prosthodontic Rest Dent, 2008; 2, 50-5.
•17. Park S., Blissett R., Susarla S., Weber P. Candida albicans adherente to surface-modified dentare resin surface. 2008, 5, 365-9.
•18. Dhir G, Berzins D., Dhuru V., Periathamby A., Dentino A. Physical properties of denture base resins potentially resistant to Candida adhesion. J Prosthodont, 2007, 6, 465-72.
•19. Rompré P, de Koninck L, de Grandmont P, Barbeau J. The relationship of myceliated colonies of candida albicans with dentare stomatitis an in vivo/in Vitro study. Int J Prosthodont. 2007, 20,14-20.