Autores.-
José Manuel Navajas Rodríguez de Mondelo. Catedrático del Departamento de Estomatología. Universidad de Granada
Cristina Lucena Martín.- Profesora Titular Departamento del Departamento de Estomatología. Universidad de Granada
Cristina Navajas Nieto.- Odontóloga. Experta en Periodoncia y Estética Dental
Rosa María Pulgar Encinas. Profesora Titular Departamento de Estomatología. Universidad de Granada
Dirección de los Autores.
José M. Navajas Rgz. de Mondelo
Dr.Oloriz nº2-10ª
18012 Granada .España
a-mail : jnavajas@ugr.es
Introducción.-
La odontología restauradora ha pasado en estos últimos años desde un puro conservadurismo a una recuperación funcional y estética lo más cercana posible a lo natural. La restauración de la funcionalidad dentaria se consigue con éxito mediante el uso de múltiples y diversos materiales, pero no así la estética de la misma. En la actualidad, disponemos de materiales estéticos muy evolucionados que nos permiten una restauración casi completa del diente enfermo, tanto en su funcionalidad como en su apariencia natural. Entendemos que la restauración del diente no es privativa solo de aquellos que por causa de la enfermedad ha perdido parte de sus tejidos duros, sino que incluye a todos los que por alteración de su color o de su forma influyen negativamente en el estado de bienestar del individuo. Todo esto hace que, hoy día, se hable más en los foros académicos y científicos de Odontología Restauradora y Estética que de simplemente Odontología Conservadora, ya que el primero es un término más amplio que abarca todas aquellas disciplinas involucradas en la restauración integral del diente afectado por la enfermedad.
Es nuestra intención, con estas publicaciones «on line» poner de manifiesto particularidades muy específicas de nuestros dientes que contribuyen de una manera importante a conseguir la restauración ideal.
Características Ópticas.
Dejando a un lado el color de nuestros dientes constituido por su tonalidad, su saturación y su valor individual, los dientes poseen una serie de características ópticas que los diferencian entre sí y que le confieren individualidad entre ellos y entre los de unos individuos y otros. Conocer estas características es muy importante para el Dentista Restaurador, ya que utilizándolas va a conseguir recuperar la función y la estética del diente, contribuyendo de este modo a mejorar el estado de salud de sus pacientes.
Estas son fundamentalmente: la translucidez, la opacidad, la opalescencia, la morfología de la dentina en su unión con el esmalte en el tercio incisal, el borde blanco incisal, las zonas de discromía coronal y la microtextura individual.
Los fabricantes de materiales dentales, tanto para restauración directa como indirecta, ponen a nuestra disposición una serie de componentes que nos permiten reproducir las mismas.
TRANSLUCIDEZ Y OPACIDAD.-
La propiedad de un cuerpo de dejar pasar la luz a su través se conoce como translucidez y lo contrario opacidad. Los dientes constituidos por esmalte y dentina en sus coronas, dejan parcialmente que la luz los atraviese. El esmalte por su naturaleza más inorgánica y cristalina es más translucido que la dentina. Esta, dependiendo de su grosor y de su contenido inorgánico es más o menos translucida. Los dientes más jóvenes son más translucidos que los maduros y los viejos, en función de la mayor cantidad de esmalte y el menor contenido de sales minerales de su dentina. La forma clínica de poner de manifiesto esta propiedad es mediante la transiluminación desde el interior de la boca hacia el exterior, dada la posición del espectador
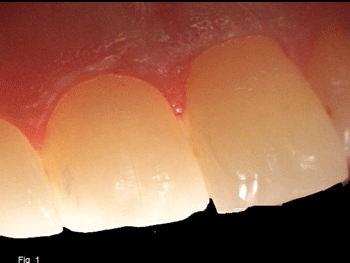
En la figura1 se puede observar la translucidez de los dientes de un adulto joven. Obsérvese que todo el diente es translucido, incluso los tejidos blandos permiten el paso de la luz intensa .
El nivel de la unión de la dentina con el esmalte en el tercio incisal condiciona en parte la translucidez del diente. Los dientes mas envejecidos son más opacos.
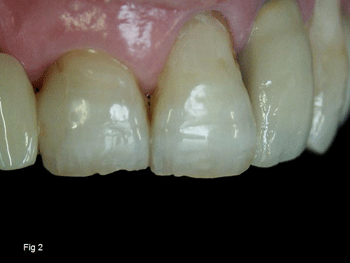
En la figura 2 observamos la opacidad de los dientes de un adulto de la tercera edad. El desgaste del esmalte del borde incisal y una dentina más envejecida y calcificada condicionan la translucidez de los mismos.
LA OPALESCENCIA.-
Una de las características más interesantes del color de nuestros dientes es lo que conocemos como Opalescencia. Esta, se caracteriza por tonalidades de color azul o ámbar que aparecen con mayor o menor intensidad en los bordes translucidos incisales de los dientes anteriores. Su presencia en las reconstrucciones dentarias da naturalidad y belleza a las mismas. Cualquier sistema cerámico o de composite que se precie, dispone entre sus totalidades de masas cerámicas, composites o tintes que permiten simular la opalescencia natural de los dientes para adaptar las restauraciones a su entorno natural.
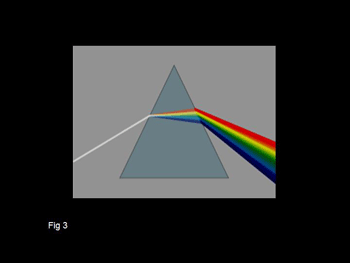
Existen ciertas confusiones al explicar el fenómeno de la opalescencia dentaria. Su secreto está relacionado con la composición de la luz: Cuando un rayo de luz pasa por un prisma translucido Fig. 3 este se dispersa por refracción en un abanico de colores, de los que apreciamos el violeta, el azul, el verde, el naranja, el amarillo y el rojo. . La desviación es máxima para los rayos de longitud de onda corta ( de 380 a 490 nm : violeta y azul), y mínima para los de longitud de onda larga ( de 560 a 760 nm, : amarillos y rojos), que casi no son desviados
El término de Opalescencia viene de las características de una gema llamada Ópalo. El Ópalo es sílice amorfo o sílice hidratado, es decir, está compuesto de dióxido de silicio, lo mismo que el cuarzo y otros minerales. Está constituido por diminutas esferas formadas por capas sucesivas de cristobalita y tridimita, dos minerales pertenecientes a la clase de los silicatos que coinciden con el cuarzo en su composición, pero que difieren de él por sus respectivas estructuras cristalinas. Estas microesferas tienen un diámetro de aproximadamente 0,1 μm y se encuentran como estructuras empaquetadas en un enrejado tridimensional. Debido a ese preciso enrejado, el ópalo es capaz de refractar los rayos de luz y descomponerlos en sus constituyentes de distinta longitud de onda. En la figura 4 podemos observar un ópalo con vetas de microcristales esféricos que difunden la luz de longitud de onda corta azul .

Pues bien el esmalte dentario se comporta, como el cuerpo translucido y cristalino que es, de una forma similar. Al incidir sobre él la luz, parte de la misma se reflejará y otra penetrará dentro de la estructura adamantina y se refractará apreciando el espectador las tonalidades azules o ámbar (amarillento-rojizas), de la opalescencia. Pero el fenómeno no es tan simple. La luz es una onda electromagnética y si los cristales de los que se compone el esmalte, tienen un tamaño igual o inferior al de la longitud de onda de la luz incidente, la onda cede parte de su energía a la corteza atómica del cristal que comienza a oscilar, de manera que un primer efecto de la interacción de la luz con los cristales de hidroxiapatita del esmalte es que la radiación incidente se debilita al ceder parte de su energía, lo mismo que le sucede a la luz del Sol cuando atraviesa la atmósfera. Evidentemente esta energía no se queda almacenada en el esmalte, pues cualquier átomo o partícula pequeña cuya corteza se agita, acaba radiando toda su energía en forma de onda electromagnética al entorno y en cualquier dirección. El proceso completo de cesión y remisión de energía por partículas de pequeño tamaño se denomina difusión de RAILEIGH. La difusión será mayor, por tanto, para las ondas más cortas y como consecuencia de ello la difusión de la luz será mayor para las de color azul y menor para las rojas. Puede pensarse que los prismas del esmalte son bastante más grandes que la longitud de onda de los rayos azules o violetas. De hecho esto es así, pero hemos de tener en cuenta que cada prisma de esmalte está constituido por infinidad de cristales de hidroxiapatita separados entre sí por una vaina orgánica y que cada cristalito hexagonal tiene unas dimensiones de 160 nm de altura por 40 nm en el eje mayor de su base. La longitud de onda del color azul ronda los 490 nm, por lo que la difusión de RAYLEIGH se produce y explica que las tonalidades de opalescencia azul se presenten en esmaltes jóvenes y por lo tanto gruesos, con gran número de cristalitos de hidroxiapatita en sus prismas. En cambio en esmaltes finos o envejecidos la refracción de la luz permite la apreciación de las tonalidades ámbar (rojo-amarillentas) debido al menor número de cristalitos y a la difusión más recta de los colores de longitud de onda mayor, al no presentarse el fenómeno de Rayleigh.

En la Fig. 5 en «A».- se pueden observar los microcristales de hidroxiapatita de un prisma adamantino a 120.000 aumentos donde puede apreciarse la independencia entre ellos. Y en «B» parecen que están rodeados por una vaina orgánica que les individualizan.
Cuando se observa un diente extraído en microscopio óptico con luz transmitida pueden observarse más claramente los tonos naranjo-amarillentos, a esto L.Vanini le llama «contra opalescencia» con luz transmitida, circunstancia que solo se produce «in vitro» o cuando utilizamos la transiluminación con fines diagnósticos. Este término no lo consideramos adecuado y puede llevarnos a confusión.

Todo lo anterior puede compararse con lo que ocurre con el color azul del cielo y el amarillento del atardecer que está relacionado con la angulación de los rayos del sol sobre la tierra y el espesor de la atmósfera sobre la que inciden que es mayor naturalmente al medio día cuando el sol está en el cenit que cuando está en poniente al atardecer. Fig 6.
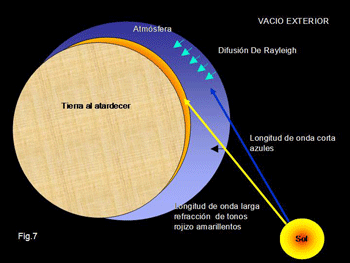
En la Fig.7 vemos lo que ocurre con la dispersión de la luz del sol al incidir sobre la tierra: durante la mayor parte del día la luz solar incide sobre las pequeñas partículas de la atmósfera con una angulación tal que facilita difundir los rayos de longitud de onda corta y por eso el cielo es azul. En cambio al amanecer y al atardecer los rayos solares tocan tangencialmente la atmósfera, de tal manera que la parte más próxima al horizonte, con menor espesor de partículas, refractan la luz de longitud de onda mayor dando tonalidades rojo amarillentas, en cambio la parte atmosférica de mayor grosor difunde las de longitud de onda menor (azules) . Este concepto de dispersión de la luz se comprende muy bien visto desde el espacio exterior. Obsérvese la fotografía de la tierra desde una nave espacial sobre el mar de la china al amanecer Fig. 8. La angulación de los rayos sobre la atmósfera ocasiona la refracción de la luz de un color u otro en función del número de partículas sobre las que incide…

La atmósfera de Marte está cargada de partículas grandes de polvo. Esto hace que no se produzca la difusión de Rayleigh de las longitudes de onda corta, azules, y si en cambio que se refracten las de longitud larga. Esta es la razón de que el color del cielo de Marte sea rojo. Fig. 9.

El vacío exterior es negro, la luz se transmite en línea recta, no hay ni reflexión ni refracción pues no existen partículas donde se produzca el fenómeno óptico que analizamos. Fig. 10 .

En relación a lo anteriormente expuesto, nuestros dientes tienen la propiedad de la opalescencia. Veamos algunos ejemplos:
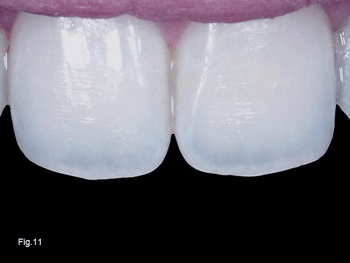

En la Figs.11 y 12 podemos observar la difusión azulada de un esmalte grueso de los incisivos superiores de unas jóvenes adolescentes. Y anaranjada en la zona incisal más fina. La opalescencia es privativa del esmalte. Las discromías dentinarias no le afectan.
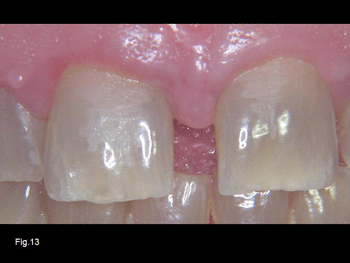
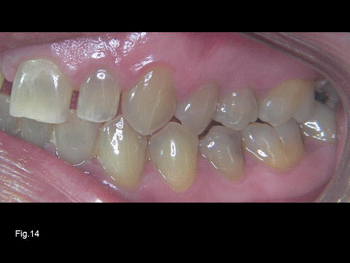
En la fotografía de la Fig. 13 podemos observar opalescencias azules y ámbar en un paciente adulto con una tinción por tetraciclinas. Y en la Fig. 14, del mismo paciente, podemos comprobar que las opalescencias se pueden presentar en todos los dientes, incluso en los molares. Así mismo apréciese como en las zonas de esmalte más fino y desgastado la tonalidad de la misma es amarillenta. Los dientes con poco grosor de esmalte suelen refractar las longitudes de onda mas largas, rojizo amarillentas y difunden poco las de longitud de onda corta azules.
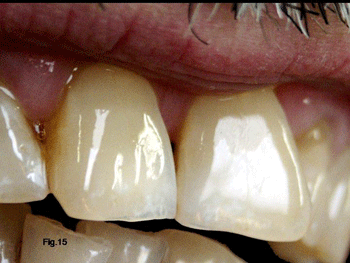
En la fotografía de la Fig. 15 pueden observarse tonalidades ámbar en los incisivos abrasionados de un adulto de 60 años de edad. Estas tonalidades anaranjadas nada tienen que ver con la tonalidad amarillenta que se produce con luz transmitida, y que se han denominado con el término de contra-opalescencia por algunos autores.
Los odontólogos disponemos de materiales para poder reproducir estas características tanto en materiales cerámicos como en resinas compuestas. La opacidad total se consigue con tintes cargados de óxidos metálicos que los hacen totalmente opacos. El distinto grado de opacidad de la restauración se obtiene con masas «dentinarias» que confieren un grado de translucidez similar a la de la dentina natural. Los materiales más translucidos se conocen como esmaltes. Los hay completamente transparentes, pero los más usados confieren además de una transparencia natural cierto grado de color que aporta naturalidad a la restauración.
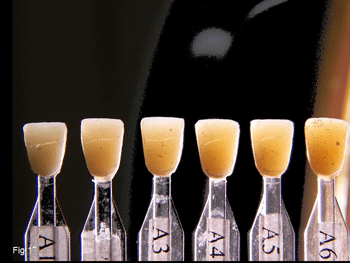
En la fotografía de la Fig.17 se observan la translucidez de muestras de composite del material restaurador «Miris de Coltène- Whaledent» de la tonalidad A de la escala de color Vita. Obsérvese que cambia la saturación del color pero no su translucidez. (Las manchitas que se observan son las sombras de los poros que presentan cada muestra).
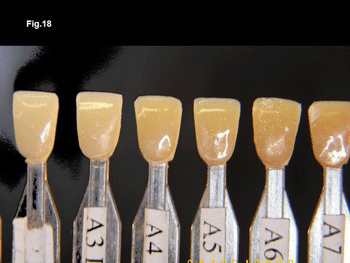
En la Fig. 18 podemos ver las mismas muestras con luz reflejada en donde la translucidez es casi imperceptible y las sombras de los poros no se aprecian. (Reflexión en espejo)
Los materiales restauradores conocidos como «esmaltes» pueden ser incluso totalmente transparentes, aunque casi siempre contienen colorantes para dar a la restauración una mejor apariencia.
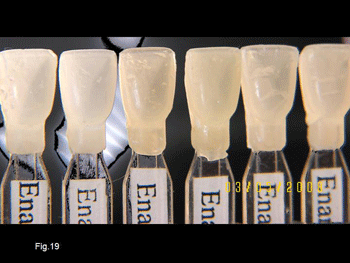
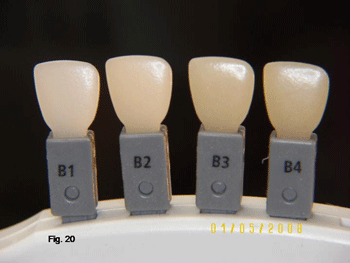
En la figura 19 observamos un muestrario de esmaltes fabricados en composite del mismo material restaurador, «Miris de Coltène- Whaledent», en donde se puede observar la translucidez de las mismas. Y en Fig 20 los de la tonalidad «B» de la escala de Vita, del muestrario del material restaurador «Artemís de Ivoclar VivadenT» con luz reflejada para apreciar la tonalidad que poseen.
La reproducción de la Opalescencia natural requiere de materiales con tonos azules o ambar, ya que los composites al no ser cristalinos la refracción de la luz no se produce. Todos los Kits de restauración dentaria suelen traer materiales para la Opalescencia.

En la Fig.21 observamos el muestrario de «efectos» del material restaurador Artemis de Ivoclar, el «B» reproduce las opalescencias azules y el «A» las rojo-amarillentas o ambar. Siendo el «C» y el «SC» utilizadas cuando se requiere mayor luminosidad en los efectos.
A continuación exponemos algunos casos clínicos resueltos con estas técnicas:
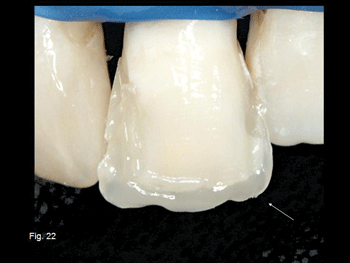
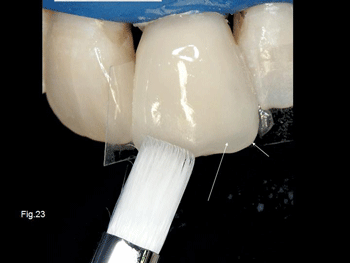
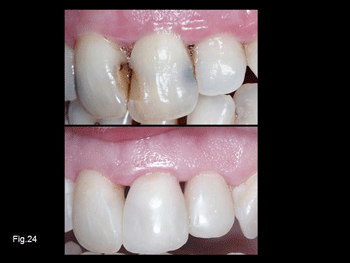
En la figura 22 se aprecia la utilización de un «esmalte» translucido para reproducir el borde incisal y proximal de la restauración y en la figura 23 como con la utilización de los opacos y la de los materiales para la opalescencia con la técnica adecuada se nos permiten resultados predecibles. La Fig. 24 muestra el antes y después de la restauración dento-periodontal.
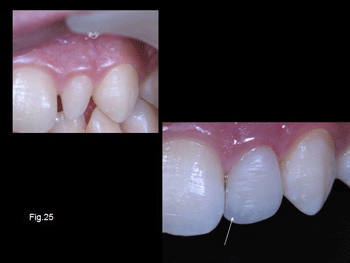
Todas estas técnicas, nos permiten reconstruir la morfología y apariencia del diente restableciendo su estética.. Cuando el diente es opaco, es poco común el fenómeno óptico de la Opalescencia. En el caso de la Fig. 25 puede observarse la reconstrucción de un diente cónico opaco y su reconstrucción con composite en la que se ha simulado la opalescencia azul, la dentina con aspecto pectiniforme y las microanatomia de la superficie vestibular conseguida.
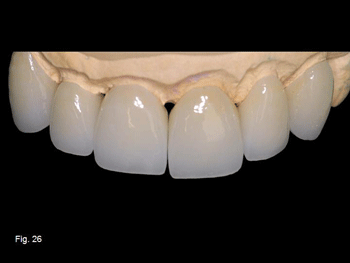
Las restauraciones con materiales cerámicos nos facilitan la obtención de las zonas translucidas y las opalescencias azules y ámbar. En la figura 26 se pueden ver perfectamente las tonalidades azules de estas carillas de cerámica en sus modelos.
Hemos tratado de transmitir la importancia de estos fenómenos ópticos, sus fundamentos físicos y la importancia de su conocimiento para la obtención de unos resultados estéticos adecuados en nuestra restauración. En un próximo artículo analizaremos la morfología de la dentina en su unión con el esmalte en el tercio incisal, el borde blanco incisal, las zonas de discromía coronal y la microtextura individual.
Bibliografía recomendada
Justiniano Casas: Óptica. ED. Librería PONS. Zaragoza. 1994.
Theo Löbsack: El Aliento de la Tierra. Ed. Labor. Barcelona. 1996.
David Malin Y Paul Murdin: Colours of the Stars. Cambridge University Press, 1984.
Dario Adolfi: .Estetica Nautural. Quintessence Books. Barcelona 2004
Claude R Rufenacht : Fundamentals Of Esthetics .Quintessence Books Chicago 1992
Pascal Magne and Urs Belser: Restauraciones de porcelana adherida. Quintessence Books. Barcelona 2004
Bruce J. Crispin: Bases prácticas de la Odontología Estética Masson Barcelona 1998
Robert Francés. Psicología del arte y de la Estética. Ediciones Akal S.A Torrejon de Ardoz Madrid 1985
L. Vannini, F. Mangani y O.Klimovskaia: Il restauro conservativo dei denti anteriori. ACME. Viterbo Italy 2005. Vol1